جدول تناوبی جالب

برای مشاهده ی تصویر در اندازه ی واقعی به ادامه ی مطلب برید..........

برای مشاهده ی تصویر در اندازه ی واقعی به ادامه ی مطلب برید..........
سنگ چخماخ با نام flint معروف می باشد، تیره رنگ می باشد و در شاخه کوارتزها قرار می گیرد Flint
نوع کوارتز آلفا می باشد که تا دمای 573 درجه سانتیگراد پایداری دارد و به صورت گرهکهایی در گچ و
سنگ آهک یافت می شود .از سنگهای حاوی سیلیس SiO2 که عموماً منشاء رسوبی دارند می باشد.
این سنگها یک پارچه بوده که به علت نقص ساختمانی در برخورد با یکدیگر جرقه زده و O-3 آزاد می
نماید این سنگ بانام سنگ آتشزنه معروف میباشد .
کلمات کلیدی:جرقه ٬ سنگ چخماق٬ کوارتز٬آتشزنه٬ سنگ
Symmetry in Chemistry
جزوه ای کامل و فوق العاده در مورد تقارن شامل مباحث تقارن،گروه های نقطه ای،جدول های کاراکتر و ... همراه با آموزش صوتی.![]()
 |
  |
 |
 |
 |
جدول های تناوبی کلیک کردنی

پوستر های جدول تناوبی
فلش های جدول تناوبی
نرم افزارهای جدول تناوبی
|
جدول های تناوبی کلیک کردنی
|
|
|
|
|
||
|
|
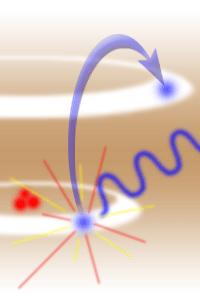
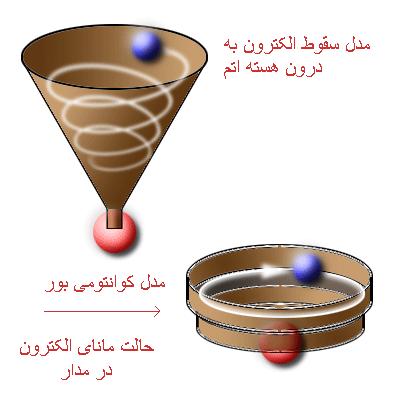
ذرات زیر اتمی
هادرون – باريون – بوزون – فرميون – لپتون – بوزون هاي شاخص – گلوئن – نوترينوها – موئون – مزون – كوارك – پيون و ....
هادرون ها (Hadrons): ذرات زيراتمي اي هستند كه از فرميون هايي چون كوارك و آنتي كوارك و بوزون هايي چون گلوئن تشكيل شده اند.
اين ذرات نيروي قوي هسته اي اعمال مي كنند. هادرون ها مانند ديگر ذرات داراي عدد كوانتومي هستند. اين ذرات ممكن است در دما يا فشار بسيار پايين خودبه خود از بين بروند.
باريون (Baryon): ذراتي هستند كه از كوارك تشكيل شده اند. براي مثال پروتون از دو كوارك بالا (u) و يك كوارك پايين (d) تشكيل شده و يا نوترون از دو كوارك پايين و يك كوارك بالا تشكيل شده.
انواع باريون طبق مدل استاندارد (SM) به صورت زير است:
بوزون (Boson): ذراتي هستند كه داري اسپين صحيح هستند. اكثر بوزون ها مي توانند تركيبي باشند اما گروه بوزون هاي شاخص (Gauge Bosons) از نوع تركيبي نيستند. در مدل استاندارد بوزون ها ذراتي براي انتقال نيرو هستند كه شامل فوتون ها (انتقال دهنده ي الكترومغناطيس) و گراويتون (انتقال دهنده ي گرانش) نيز مي شوند. اتم ها نيز مي توانند بوزون باشند. براي مثال هليم – 4 يك بوزون با اسپين گويا است. در كل تفاوت زيادي بين استاتيك فرميوني (اسپين نيمه صحيح) و بوزوني وجود ندارد مگر در مورد اجرام با چگالي بالا كه اين مورد نيز پيرو استاتيك ماكسول – بولتزمن مي باشد. بر همين مبنا هم بوزون ها و هم فرميون ها ذراتي كلاسيك شناخته مي شوند. بوزون هاي شاخص (Gauge Bosons): ذرات بوزوني مي باشند كه حامل نيروهاي بنيادين طبيعت مي باشند.
بوزون هاي شاخص خود 3 دسته اند: فوتون ها – بوزون W&Z (بوزون هايي كه بدون بار الكتريكي هستند را با Z نشان مي دهيم و آن دسته اي را نيروهاي ضعيف هسته اي دارند با W نشان مي دهيم) و گلوئن ها.
گلوئن (Gluon): ذراتي بدون جرم و خنثي از خانواده ي بوزون هاي شاخص هستند و داراي اسپين 1 هستند. اين ذرات زيراتمي باعث پايدار بودن كوارك ها در هسته ي اتم (پروتون ها و نوترون ها) در كنار همديگر مي شوند. البته جرم اين ذرات از آنجاييكه بسيار كم است (MeV) از آن صرف نظر مي شود. بوزون هاي W&Z: جرم بوزون هاي Z در حدود 91.1876 (GeV/C2) و نوع W آن 80.403 (GeV/C2) مي باشد. هردوي آنها داراي اسپين 1 هستند و واكنش آنها از نوع ضعيف مي باشد. اين بوزون ها از خانواده ي بوزون هاي شاخص هستند.
نوترينو (Neutrino): اين ذرات از خانواده ي فرميون ها و گروه لپتون ها هستند و اسپين 0.5 دارند. نوترينوها اغلب تنها توسط نيروهاي ضعيف و گرانش واكنش انجام مي دهند. مدل استاندارد پيش بيني كرده كه نوترينوها بدون جرم باشند اما در آزمايشات جرم نوترينو را گرچه بسيار كوچك اما اندازه گيري كرده اند. نوترينوها اغلب به صورت ذرات منفرد ديده نمي شوند و در قالب الكترون نوترينو (2.2 eV) يا موئون نوترينو (170 KeV) و تاو نوترينو (15.5 MeV) ديده مي شوند. هرچند دانشمندان هنوز يكي بودن پاد نوترينو و نوترينو را تاييد نكرده اند اما آزمايشات به روشني اين مطلب را اثبات مي كنند. به همين دليل در مدل استاندارد پاد اين ذرات نيز تعريف شده است. (براي مثال الكترون آنتي نوترينو).
موئون (Muon): اين ذرات نيز از خانواده ي فرميون ها و گروه لپتون ها هستند و داراي اسپين 0.5 مي باشند. باز اين ذرات همانند الكترون است و جرمشان 105.6583 (MeV/C2) مي باشد. اعمال واكنش در اين ذرات به صورت نيروهاي گرانشي و الكترومغناطيسي و همچنين نيروهيا ضعيف هسته اي است. اين ذرات داراي پاد نيز مي باشند. عمر اين ذرات اغلب بيش از 2.2 ميكروثانيه نيست كه همين گونه نيز از ديگر لپتون ها و مزون ها عمر بيشتري دارند. موئون با جذب الكترون مي تواند اتم موئونيم (Muonium) را بسازد كه شعاع آن تقريبا برابر با هيدروژن است. به همين دليل تا به حال اين ذرات در اتم ديده نشده اند.
مزون (Meson): مزون نوعي هادرون با اسپين صحيح مي باشد. مزون ها اصولا تركيبي هستند به صورتيكه در آنها كوارك و آنتي كوارك هم ديده مي شود! مزون ها شامل 3 دسته ي اصلي منفي – مثبت و صفر مي باشند: مزون صفر سنگين (B0) – مزون مثبت يا پيون (Π+) - مزون منفي يا كائون (K-) – مزون صفر سبك يا اتا (Cη) و مزون هاي مثبت سنگين يا رو (+ρ).
پيون (Pion): نوعي از مزون ها هستند كه داراي بار واحد (هم مثبت و هم منفي) مي باشند. پيون ها زا آن جهت مهم هستند كه داراي اسپين صفر مي باشند و سبك ترين مزون ها هستند. جرم آنها Π0 = 134.976 (MeV/C2) و Π± = 139.570 (MeV/C2) مي باشد.
كوارك ها (Quarks): اين ذرات شامل 6 نوع مي شوند: كوارك هاي بالا (بار 3/2 و جرم 0.003) – Up (u) كوارك هاي پايين (بار 3/1- و جرم 0.006) – Down (d) كوارك هاي ربايشي (بار 3/2 و جرم 1.3) – Charm (c) كوارك هاي غير ربايشي (بار 3/1- و جرم 0.1) – Strange (s) كوارك هاي زير (بار 3/2 و جرم 175) – Bottom (b) كوارك هاي فوق ( باز 3/1- و جرم 4.3) – Top (t) دايون (Dyon): ذراتي فرضي كه هم بار الكتريكي دارند و هم بار مغناطيسي و اگر در شرايطي بار الكتريكي انها سفر باشد تك قطبي خواهند بود. به اين شرايط خاص شرايط كوانتيده شدن ديراك – اشوانزيگر – اشوينگر مي گويند. (توجه كنيد كه اين شرايط به تك قطبي هوفت – پولياكوف بر نمي گردد بلكه مخصوص تك قطبي ديراك است و لازمه ي آن تعريف هوموتوپي براي توپولوژي فضا و زمان ناپيوسته است). اكثر تئوري هاي وحدت (GUT) وجود چنين ذره اي را پيش بيني كرده اند.
گراويتون (Graviton): ذراتي فرضي هستند كه داراي جرم و بار صفر و اسپين 2 مي باشند. اين ذرات بيشتر در تئوري هاي كوانتومي به عنوان نتيجه اي از نسبيت مطرح مي شود. به طوريكه QCD نيز از آنها نام مي برد. چنين ذراتي (بدون جرم) تا به حالا ديده نشده اند. بنابراين حرف زدن در مورد ويژگي هاي آنها بسيار سخت است
از برهم نش ترکیب های کئوردیناسیون با میدان مغناطیسیس می توان تعداد الکترون های منفرد در کمپلکس راتعیین کرد. با دانستن تعدا الکترون های منفرد نیز می توان حالت اکسایش کمپلکس را تعیین کرد.
همه مواد با میدان مغناطیسی برهم کنش دارند و هیچ استثنایی در این مورد وجود ندارد.مواد براساس راه های برهم کنش با میدان مغناطیسی به چند دسته زیر تقسیم می شوند.
دیا مغناطیس و پارا مغناطیس از ویژگی های اتم ها و مولکول های منفرد هستند در صورتی که آنتی فرومغناطیس و فرومغناطیس از رفتار جمعی تعداد زیادی سلول واحد در یک بلور ناشی می شوند.
تعداد اتم های کئوردیناسیون دهنده به اتم مرکزی یا به عبارت دیگر تعداد لیگاندهایی که در اطراف اتم مرکزی قرار گرفته اند را عدد کئوردیناسیون یم کمپلکس می نامند.عامل های متفاوتی در به وجود آمدن عدد های کئوردناسیون دخالت دارد.این عامل ها عبارتند از:
ماهیت لیگاندها(کاتیونی یا آنیونی بودن لیگاند و تعداد دندانه های آن)،اندازه اتم مرکزی و لیگاندها،آرایش الکترونی،عدد اکسایش و انرژی اوربیتال های اتم مرکزی،خصلت مغناطیسی کمپلکس(پراسپین یا کم اسپین بودن) و انرژی پایداری بلور(CFSE).
کملکس های یک یون فلز واسطه معین که عدد کئوردیناسیون یکسان دارند،به طور معمول دارای طیف های الکترونیکی و خواص مغناطیسی نزدیک به هم هستند.
متداول ترین عدد کئوردیناسیون ۴ و ۶ هستند.عددهای کئوردینانسیون ۲،۳،۵،۷،۹ کمیاب اند و عدد کئوردیناسیون ۱۱ بسیار کمیاب است.عددهای کئوردیناسیون ۸،۱۰،۱۲ متداول تر از موردهای اخیر است.عدد کئوردیناسیون ۱ نیز کمیاب است.
شیمی معدنی۲(جلد اول)
تالیف:دکترحسین آقا بزرگ،دکتر شهره نفیسی،دکتر حمیدرضا آقا بزرگ، محمد بوسفی
گازهای دو اتمی اند که پیوند کوالانسی ساده متصل اند و بین مولکول ها پیوند واندروالسی ضعیف است.
با گرفتن ۱ الکترون به آرایش گاز بی اثر بعد از خود می رسند.
هر عنصری می تواند یون بعد از خود را به صورت گاز دو اتمی تولید کنه برای مثال گاز فلوئور در مجاورت نمک طعام(به صورت یونیزه با آنیون کلر) می تواند تولید گاز کلر کند.
کاربرد ترکیبات فلئور:
کریولیت در فرآیند هال
فرئون سرما زا در یخچال ها
در تفلن ها
کاربردکلر:
برای تصفیه آب به منظور ضد عفونی کردن
در صنعت نفت
پلاستک سازی
علف کش ها
آفت کش ها
مواد غذایی
رنگرزی
تهیه برم و ید
کاغذسازی
در پزشکی نیز کاربرد دارد
کاربرد برم:
برای تهیه اتیلن برمید از آن استفاده می شود و اتیلن برمید همرا با تترا اتیل سرب به عنوان ضد کوبش در بنزین ها استفاده می شده که امروزه به دلیل آلایندگی سرب این ماده بنزین ها حذف شدهاست.
در شیمی معدنی در مورد گستره وسیعی از موضوعات از جمله: ساختمان اتمی، بلورنگاری (کریستالوگرافی)، انواع پیوندهای شیمیایی اعم از پیوندهای کووالانسی، یونی، هیدروژنی و ...، ترکیبات کوئوردیناسیون و نظریههای مربوطه از جمله نظریه میدان بلور و نظریه اوربیتال مولکولی، واکنشهای اسید و باز، سرامیکها، تقارن مولکولی و انواع بخشهای زیرطبقه الکتروشیمی (برقکافت، باطری، خوردگی، نیمه رسانایی و غیره) بحث میشود.
در باب اهمیت شیمی معدنی، ساندرسن چنین نوشته است:
در واقع بیشترین مباحث علم شیمی را دانش اتمها تشکیل میدهد و کلیه خواص مواد و ترکیبات، به ناچار ناشی از نوع اتمها و روشی است که با توجه به آن، اتمها به یکدیگر میپیوندند و مجموعه تشکیل میدهند و از طرف دیگر کلیه تغییرات شیمیایی متضمن بازآرایی اتمهاست.
طبقه بندی مواد معدنی
در یک مفهوم گسترده، مواد معدنی را میتوان در چهار طبقه تقسیم بندی نمود: عناصر، ترکیبات یونی، ترکیبات مولکولی و جامدات شبکهای یا بسپارها.
عناصر: عناصر دارای ساختارها و خواص بسیار متفاوت هستند. بنابراین میتوانند به یکی از صورتهای زیر باشند:
گازهای اتمی (Kr , Ar) و یا گازهای مولکولی :{O_2 , H_2}
جامدات مولکولی :
{C_6 , S_8 , P_4}
مولکولها و یا جامدات شبکهای گسترش یافته (الماس، گرافیت)
فلزات جامد (Co , W) و یا مایع (Hg , Ca)
ترکیبات یونی: این ترکیبات در دما و فشار استاندارد همواره جامدند و عبارتاند از:
ترکیبات یونی ساده، مانند NaCl که در آب یا دیگر حلالهای قطبی محلولاند.
اکسیدهای یونی که در آب غیر محلولاند، مانند () و اکسیدهای مختلط همچون اسپنیل (
{MgAl_2O_4})، سیلیکاتهای مختلف مانند:
{CaMg(SiO_3)_2} و ...
دیگر هالیدهای دوتایی، کاربیدها، سولفیدها و مواد مشابه. چند مثال عبارتست از: BN , GaAs , SiC , AgCl.
ترکیباتی که دارای یونهای چند اتمی (به اصطلاح کمپلکس) هستند، همچون:
{Ni(H_2O)_6{2+} , Co(NH_3)_6{3+} , SiF_6^{2-}} .
ترکیبات مولکولی: این ترکیبات ممکن است جامد، مایع و یا گاز باشند و مانند موارد زیر :
ترکیبا دوتایی ساده همچون Latex Error:
{UF_6 , OsO_4 , SO_2 , PF_3} .
ترکیبات پیچیده فلزدار همچون Latex Error:
{RuH(CO_2Me)(PPh_3)_3 , PtCl2(PMe_3)_2} .
ترکیبات آلی فلزی که مشخصا پیوندهای فلز به کربن دارند، مانند Latex Error:
{Zr(Cn_2C_6H_5)_4 , Ni(CO)_4} .
جامدات شبکهای یا بسپارها: نمونههای این مواد شامل بسپارهای متعدد و متنوع معدنی و ابررساناها است. فرمول نمونهای از ترکیبات اخیر
{YBa_2Cu_3O_7} است.
تفاوت ساختاری مواد آلی و معدنی :
ساختار بسیاری از مواد آلی از چهار وجهی مشتق میشود. فراوانی آنها به این دلیل است که در مواد آلی ساده، بیشترین ظرفیت کربن و همچون بیشتر عناصر دیگری (به استثنای هیدروژن) که معمولاً به کربن پیوند میشوند، چهار است. اما اجسام معدنی وضعیت ساختاری بسیار پیچیدهای دارند، زیرا اتمها ممکن است خیلی بیشتر از چهار پیوند تشکیل دهند. بنابراین، در مواد معدنی اینکه اتمها پنج، شش، هفت، هشت و تعداد بیشتری پیوند تشکیل دهند، امری عادی است. پس تنوع شکل هندسی در مواد معدنی خیلی بیشتر از مواد آلی است.
ساختار مواد معدنی اغلب بر اساس تعدادی از وجیهای با نظم کمتر، نظیر دو هرمی با قاعده مثلث، منشور سه ضلعی و غیره و همچنین بر اساس شکلهای باز چند وجیهای منتظم یا غیر منتظم که در آنها یک یا چند راس حذف شده است، نیز مشاهده میشود.
رابطه شیمی فیزیک و شیمی معدنی
در توجیه موجودیت مواد معدنی و در توصیف رفتار آنها، به استفاده از جنبههای خاصی از شیمی فیزیک، بخصوص ترمودینامیک، ساختارهای الکترونی اتمها، نظریههای تشکیل پیوند در مولکولها، سینتیک واکنش و خواص فیزیکی مواد نیاز داریم. بنابراین با استفاده از شیمی فیزیک میتوان به ساختار اتمی و مولکولی، تشکیل پیوند شیمیایی و دیگر اصول لازم برای درک ساختار و خواص مواد معدنی پرداخت.
برگرفته از «http://fa.wikipedia.org»
به طراحی و یا بازطراحی مولکول ها ، مواد و دگرگونی های شیمیایی در راستای سالم تر کردن آن ها برای انسان و محیط زیست شیمی سبز می گویند.
به طور کلی شیوه ای برای جلوگیری از آلودگی های شیمیایی است.
کلمات کلیدی:شیمی سبز٬ شیمی٬ سازگار با محیط زیست٬ شیمی پاک ٬قابل تجزیه٬مواد اولیه نو شدنی
از نظر فراوانی دومین فلز آهن می باشد که در صنایع مختلف کاربرد دارد.پایه اقتصادی کشور محسوب می شد تا زمانی که انرژی های نفت و گاز و.. روی کار آمد.
کانی های موجود در زمین مگنتیت Fe3O4 ،هماتیت Fe2O3 ، پیریت FeS2 هستند که برای تولید و استخراج آهن خالص کاربرد دارند و از پیریت خیلی به دلیل مقرون به صرفه نبودن آن استفاده نمی شود. هرفلزی سه مرحله استخراج را طی می کند به شرح زیر:
فولاد خود به سه دسته تقسیم می شود که به شرح زیر است:
فولاد آب دیده که حتما اسم آن به گوشتان خورده فولادی است که بسیار حرارت دیده و ذوب شده و یکباره آن را داخل آب سرد می کنیم در نتیجه خیلی سخت شده و دربرار فشار زیاد و شکنندگی و شرایط سخت مقوم شده است.
آهن اگر دربرابر رطوبت آب و اکسیژن قرار بگیرد دچار خوردگی می شود.
عوامل تشدید کننده خوردگی:
۱- شوری آب ۲- ناخالصی ۳- رطوبت همراه با اکسیژن ۴- عوامل کششی و خمشی
راه های جلوگیری:
۱- رنگ کاری
۲- روغن کاری
۳-استفاده از آند فناشونده که زودتر از آهن اکسید می شود و مانع از اکسید شدن آهن می گردد و بیشتر در مواقع دفن آهن کاربرد دارد.
گاز های نجیب در سال ۱۹۶۲ کشف شدند.
رادون رادیو اکتیو است همه ایزوتوپ های رادون رادیو اکتیو اند.در درمان سرطان کاربرد دارند و که با ساطع کردن ذرات آلفا سلول های سرطانی را مورد حمله قرار می دهند.
هلیوم در بالن ها برای بالا بردن استفاده می شود چون از هوا سبکتر است باعث بالا رفتن بالن می شود
نئون در چراغ ها کاربرد دارد
آرگون در لامپ ها جوشکاری و لحیم کاری کاربرد دارد.
آمونیاک گازی شکل است بوی تند و زننده دارد و ساختار هرمی دارد.
از کاربرد های آمونیاک می توان به تهیه نیتریک اسید-کودشیمیایی نیتروژن دار- اوره -پاکننده - سرد کننده - پلاستیک ها و برای شناسایی در آزمایش ها به عنوان شناساگر اشاره کرد.
نیتریک اسید اولین بار توسط جابربن حیان از تقطیر مخلوط زاج سبز و شوره(نمک های قلیایی) بدست آمد.
اسید نیتریک را باید مانند پراکسید هیدروژن در ظروف تیره نگهداری کرد زیرا در اثر نور خورشید به O2 ،H2O و NO2 می شود.
از کاربردهای نیتریک اسید در کودهای شیمیایی در مواد منفجره ،اسیدپیکریک،در واکنش های شیمی آلی برای نیتروژندار شدن و پلاستیک ها.
کلمات کلیدی:کاربرد٬مونیاک٬نیتریک آسید٬اسید٬نگهداری اسید نیتریک ٬زاج سبز٬
شوره٬ کودشیمیایی
کاربرد صنعتی اکسیژن
فسفر به میزان ۰.۱۳-۰.۱۲٪ در پوسته ی زمین یافت می شود . و در کانی آپاتیت و در سنگ های معدنی دیگر نیز یافت می شود . از کانی آپاتیت (کلسیم فسفات) زمانی فسفر را استراج می کنند که میزان فسفر موجود در آن ۱۵٪ باشد.از آلوتروپ های مختلف فسفر ۱-فسفر سفید ۲-فسفر قرمز ۳-فسفر سیاه را میتوان نام برد. فسفر سفید به صورت چهار وجهی بوده و به صورت خود به خود با اکسیژن واکنش می دهد بنابراین باید زیر آب نگهداری شود . فسفر قرمز از گرم کردن فسفر سفید تا دمای ۲۵۰ بدست می اید. اما ساختار آن هنوز شناخته نشده است ولي احتمال مي رود که ساختاري شبکه اي داشته باشد . فسفر سياه ساختاري شبيه به گرافيت دارد يعني ساختاري لايه اي و رسانا . هم چنين عنصري کمياب است .
کاربرد هاي آن : ۱- تهيه فسفين
۲- تهيه اسيد فسفريک
۳- در جعبه هاي کبريت
۴- در کود هاي شيميايي
۵-در صنايع غذايي
۶- در نساجي و در رنگرزي نيز کاربرد دارد.
تهيه یک نمک مضاعف و یک کمپلکس و مقایسه آنها و تهیه زاجها و بررسی رشد بلورهای آنها
هدف از انجام اين آزمايش تهيه نمک مضاعف سولفات آمونيم مس(II) و نمک مضاعف سولفات آمونيم نیکل(II) و کمپلکس تترا آمين مس(II) و مقايسه پاره ای از خواص نمک ساده، نمک مضاعف و نمک کمپلکس و همچنین تهيه زاج های کروم، آلومينيوم و آهن با استفاده از واکنشگر های لازم و بررسی رشد بلوری آن ها می باشد.
در کمپلکس ها پيوند بين فلز و گروه های غير فلزی دهنده الکترون (ليگاند) از نوع پيوند کئورديناسيون می باشد. ليگاند ها را بسته به تعداد اتم کئوردينانس شونده، به ليگاند های يک دندانه، دو دندانه و... تقسيم می کنند. ليگاند های کی ليت دهنده می توانند همزمان از بيش از يک موقعيت به فلز متصل شوند. کی ليت ها کمپلکس هايی پايدارند و حلقه های 5 و 6 عضوی آن ها پايدارتر هستند.
بقیه مطلب در قسمت ادامه مطلب آمده
پتاسیم:
کاربرد:
سزیم:
همراه پتاسیم در سنگ های معنی به خصوص سیلیکات ها یافت می شود. و در ساخت فتوسل ها(مثل چشم الکتریکی که پیام نوری را به پیام الکتریکی تبدیل می کند.) کاربرد دارد.
فرانسیم:در طبیعت به صورت پایدار نیست و به اشعه های آلفا ، گاما وX تبدیل می شود.
قرار بود کاربرد های فلزات گروه اول رو بگم لیتیم رو پست های قبلی گفتم.اما فراموشم شد که بقیه رو بگم امروز داشتم برا امتحان می خوندم یادم اومد.
نخستین Duvy در سال ۱۸۰۱ از تجزیه سود سدیم(Natrum) تهیه کرد.امروزه برای تهیه سدیم از الکترولیز نمک سدیم کلرید استفاده می شود.که منبع آن آب دریاست.
کاربرد:
کربنات سدیم را از آمونیاک به روش سلوی تهیه می کنند.
نیم رسانا دو نوع است . نوع n نوع p (هر دو از نظر الکتریکی خنثی هستند.)
نوعn :افزودن عنصرگروه ۵ به سیلیسیم (ناخالصی دهنده) ۴ الکترون از ۵ الکترون لایه ظرفیت خود را با اتم های سیلیسیم مجاور در تشکیل پیوند به اشتراک گذاشته و الکترون پنجم آزاد باقی می ماند.این الکترون در این حالت می تواند رسانای جریان برق باشد.
نوع p :افزودن عناصر گروه سوم جدول تناوبی به سیلیسم (ناخالصی پذیرنده)یک حفره مثبت در این صورت ایجاد می شود.که گردش الکترون آنجا انجام می شود.
در تراشه ها،ترانزیستورها،دیودها و فتوسل ها(پیل نوری) مثل باتری های خورشیدی نیم رسانا های نوعp و n کاربرد دارد.
رسانایی در اثر رفتن الکترون ها از نوار ظرفیت به نوار رسانش به وجود می آید در فلزات منطقه گپ یا فاصله وجود ندارد پس به راحتی این انتقال صورت می پذیرد. و در Si با تشکیل نیم رسانا نوع n یا p این فاصله کم شده و باعث رسانایی آن می شود.
سیلسیوم به صورت آزاد وجود ندارد و در طبیعت و در کانی های سیلیکاتی موجود است.
ساختاری مانند الماس دارد.خاصیت نیمه فلزی و شبه فلزی دارد.
طول پیوند کربن با کربن ۵/۱۴۱ پیکومتر است. و فاصله دو لایه ۳۳۵ پیکومتر است.هیبریداسیون sp2 دارد.
چون گرافیت ساختار لایه ای دارد بعضی مولکول ها یا یون ها در آن نفوذ می کنند و ترکیبات لاملار به وجود می آورند.
طول پیوند کربن - کربن ۱۴۵ پیکومتر است.
الماس مصنوعی در دمای ۲۰۰ درجه سیلسیوس تحت فشار بالای دستگاه های پرس تهیه می شود.در جوش کاری از الماس مصنوعی استفاده می شود.
آخرین ترکیب تهیه شده که کربن ها با هم پیوند داده اند فولون C60 است که حالت منظم دارد و شبیه به توپ فوتبال است.
۱۰ نکته درباره فلزات قلیایی:
۱- الکتروپزتیوهستند
۲- بعد از گروه اول عناصری واکنش پذیرترند.
۳- به صورت آزاد یافت نمی شوند و از الکترولیز نمک های مذابشان به دست می آیند.
۴- شعاع اتمی هریک از این عناصر کوچکتر از عناصر گروه اول هم دوره خود می باشد.به علت بار موثر هسته که چون در این جا بیشتر است شعاع اتمی کوچکتر شده.
۵- دمای ذوب و جوش و چگالی آنها بیشتر از گروه ۱ است.
۶- این فلزات قلیایی خاکی سختر از قلزات قلیایی اند.(به صورت نوار در می آیند ولی با چاقو مثل فلزات گروه یک بریده نمی شوند.
۷- در آرایش الکترونی خود ۲ الکترون ظرفیتی دارند و با از دست دادن این دو الکترون به آرایش بی اثر می رند.
۸- سفید رنگ اند با جلای نقره ای
۹- رسانای خوب الکتریکی هستند ولی در کابل های برق و سیم کشی به دلیل گرانی استفاده نمی شود و به جای آن از مس که فراوان تر و ارزان تر است استفاده می شود.
۱۰- در مورد انرژی یونش E2 کمی بیشتر از E1 است و E3 آن ها خیلی بیشتر است چون در این حالت باید از یک آرایش بی اثر الکترون بردارند و جهش در E3 صورت می گیرد.
متشکر از نظرات سازندتون.![]()
سلام به همگی دفعه قبل خواص کلی گروه اول جدول تناوبی رو براتون گفتم و گفتم برای این که پست طولانی نشه خواص کابرد های هر یک از عناصر رو در پست های جداگانه قرار می دم و خواستم و بازم ازتون می خوام که نظرتون رو در مورد این کار بگید.
لیتیم Li :
1- در طبیعت به صورت سیلیکات هستند. Al2 (Li,K)Si3O9(F,OH) شاید برای بعضی ها سوال باشه که عناصری داخل پرانتز اومده به چه معناست در جواب باید گفت که این عناصر به صورت ناخالصی در ترکیب وجود دارند.
2- چون نسبت بار به شعاع در این عنصر عدد بزرگی است خواص آن با سایر عناصر گروه متفاوت است و خواص مشابه منیزیم دارد. شاید تعجب کنید ولی به این خواص خواص قطری و مورب می گویند.که در این مورد یک عنصر از گروهی با عنصر گروه بعدی که یک دوره از آن نیز پایین تر است خواص مشابه دارد همان خواص مورب است.
کاربرد :
1- داروی رفتار(لیتیم کربنات)
2- برای تهیه آلکیل ها و آریل ها
3- برای تهیه شیشه های ایمنی LiO2
4- در جذب نیتروژن(N2) استفاده می شود.
سلام به همگی امیدوارم لحظات خوش و پرباری رو در وبلاگ بگذرونید و مطالب مورد قبولتون باشه و پیشا پیش از نظراتتون متشکرم.![]()
![]() می دونید من نظرم اینکه مطلب کوتاه باشه تا خواننده حوصلش بیاد بخونه بخصوص مطالب علمی برا همین سعی می کنم حدالامکان مطالب رو مختصر و مفید بیان کنم بهم بگید چقدر در این کار موفق بودم.
می دونید من نظرم اینکه مطلب کوتاه باشه تا خواننده حوصلش بیاد بخونه بخصوص مطالب علمی برا همین سعی می کنم حدالامکان مطالب رو مختصر و مفید بیان کنم بهم بگید چقدر در این کار موفق بودم.
اینم جلسه دوم شیمی معدنی که براتون میگم. درس این جلسه درباره گروه اول جدول تناوبی است به خواص عناصر این گروه توجه کنید.
۱- واکنش پذیرترین فلزات جدول هستند.(الکتروپزتیو هستند)الکترو پزتیو یعنی تمایل به از دست دادن الکترون دارند.
۲-هیچ کدام را به صورت آزاد در طبیعت نمی توان یافت.تمامی آن ها را از الکترولیز نمک های مذاب و خشک تهیه می کنند.
۳-همه رنگ نقره ای دارند به جز سزیم که زرد طلایی هست.
۴-نرم اند و با چاقو بریده می شوند.(در هنگام بریدن قسمت براق و نقره ای رنگی را مشاهده می کنید اما روی این عناصر کدر است و به دلیل همان واکنش پذیری بالاست که اکسید شده و برای جلوگیری از این امر این عناصر درون نفت نگهداری می شوند.)
۵-دمای ذوب و جوش پایینی دارند
۶-رسانا های خوب گرما و الکتریسیته(به دلیل وجود پیوند فلزی)
۷-اثرفوتوالکتریک دارند(برای اینکه به پایداری برسند انرژی آزاد می کنند و اگر این انرژی در حد مرئی باشد به صورت رنگ مشاهده می شود)البته این برداشت من از صحبت های استادمون بود اگر ایرادی درش وجود داره بهم بگید خوشحال می شم ![]()
۸-اولین انرژی یونیزاسیون آن ها پایین و دومین انرژی یونیزاسیون بالایی دارند(با از دست دادن اولین الکترون چون عناصر این گروه به حالت پایدار می رسند تمایل به از دست دادن دارند پس در نتیجه در مقابل این از دست دادن الکترون مقاومت زیادی نمی کنند و انرژی یونیزاسیون اولیه پایین است اما وقتی می خواهیم دوم الکترون از این عناصر جدا کنیم از یک حالت پایدار می خواهیم یک الکترون بگیریم و با مقاومت روبرو شده و درنتیجه دومین انرژی یونیزاسیون بالایی داریم)
۹-کاهنده(احیاکننده)قوی هستند.(به دلیل آرایش الکترونی خاص که راحت تر الکترون از دست می دهند و کاهنده عنصری است که الکترون از دست می دهد و خود اکسید می شود)
۱۰-هیدروکسیدهای این فلزات خاصیت قلیایی بالایی داند.
سلام به همه بازدیدکنندگان محترم امید وارم لحظات خوشی رو در وبلاگ بگذرونید اگر دوست داشتید در مسابقه شرکت کنید اگر هم خواستید در همایش ۲۶ مهر ثبت نام کنید.جهت هر کدوم از دو کار نام برده به ترتیب در قسمت موضوعات وبلاگ به قسمت مسابقه و اطلاعیه همایش های شیمی مراجعه کنید .
خوب از اینا که بگذریم می خوام اولین جلسه شیمی معدنی رو که درس گرفتم براتون بنویسم که مقدمه ای از جدول تناوبی است.
جناب مندلیف و جناب روتامر به صورت هم زمان اما جداگانه شروع به درست کردن جدول عناصر شیمیایی شدند. و من و شما رو بدبخت کردن و ما مجبوریم کم و بیش جدول رو حفظ کنیم.![]()
از اونجایی که جناب مندلیف بچه ی زرنگی بودن زود تر ما رو بدبخت می کنن و واین جدول رو به نام خودشون در میارن.در حین کار که داشتن برای خودشون نفرین آیندگان(ما) رو می خریدن ۲ جا با مشکل روبرو شدن چون اساس طبقه بندی ایشون خواص شیمیایی مشابه و عدد جرمی بود. در ترتیب کبالت و نیکل عدد جرمی کبالت بیشتر از نیکل بود در صورتی که باید حالت عکس وجود می داشت همین مشکل در رابطه با ید و تلوریم نیز وجود داشت که جرمی اتمی ید بیشتر از تلوریم بود.
البته ایشون دست از کار نکشیدند و خواص برخی از عناصری که کشف نشده بود رو از روش خواص میانگین بدست آوردن و پیشبینی کردن یعنی باتوجه به خواص عناصر هم گروه و هم ردیف کشف شده خواص عناصر مجهول رو پیش بینی کردن.
البته بقیه هم در بدبخت کردن ما سهم داشتن البته این آقای مزلی نگذاشت ما خیلی از اینی که هست بدبخت تر شیم و سردرگم هم بشیم بنابراین لطفی در حق من و شما کرد و ایراد جدول جناب مندلیف رو برطرف کرد و جدول رو بر اساس عدد اتمی تنظیم کرد.
جدول فعلی که در دست من و شماست دارای ۱۸ ستون است ۸ گروه اصلی و ۱۰گروه عناصر واسطه
اولین گروهی که مورد بررسی قرار می دیم گازهای بی اثر یا گازهای نجیب هستن تک اتمی و بی رنگ هستن و از لحاظ شیمیایی ومغناطیسی خنثی هستند.
گروه بعدی عناصر اصلی یا عادی هستن :که اوربیتال های s و p در حال پر شدن هستن
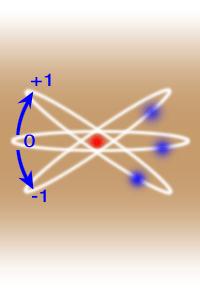
3- عناصر واسطه اصلی یا عناصر d:اوربیتال های d در حال پرشدن است از اسکاندینم(Sn) تا روی (Zn) و هم گروه های آن ها را در برمی گیرد همه فلز هستند ترکیبات رنگی دارند و پارامغناطیس هستند یعنی اغلب اوربیتال هایی دارند که دارای تک الکترون است.
4-عناصر واسطه داخلی عناصرf یا عناصرمیانه :شامل لانتانیدها و آکتانیدها هستند و اوربیتال fدر حال پرشدن است عناصر نادر یا کمیاب هم می گن