شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.تشکیل مخازن نفت , پالایش نفت
تشکیل مخازن نفت |
تماس روزانه با آلایندههای سمی
دید کلی
قوانین محیط زیست ، کیفیت هوای محیط باز را بهبود بخشیده است. اما به مشکلات فضای بسته توجه زیادی نشده است. تصور کنید قاتلی آزاد است، کسی که به قربانیان خود شلیک میکند و میگریزد. بدون شک بررسیهای پلیس با مشاده صحنه جنایت و جستجوی دقیق نشانه و سرنخ همراه است. آنها از جسد عکس میگیرند، انگشت نگاری میکنند و از شهود بازجویی میکنند. گلوله ، آزمایش میشود. سپس فرد مسئول ، این اطلاعات را برای تشخیص دقیق آنکه چه کسی مجرم است، بکار میبرد.
اما در نظر بگیرید که پلیس روش دیگری اتخاذ کند. چه خواهد شد اگر آنها تصمیم بگیرند با آزمودن تمام سلاحهایی که اخیرا آتش شدهاند، شروع کنند؟ مطمئنا اسلحه مورد نظر یکی از همین سلاحهاست و آنها درست میگویند، حتی ممکن است موفق به شناسایی قاتل بشوند، اما پیش از آن باید برای آزمودن سریع همه سلاحهای گرمی که در درست مامورات قانون ، سربازان و شکارچیان کبک است، انرژی فراوانی صرف کنند. در دنیایی با منابع نامحدود ، احتمالا آنها پیش از آنکه به پیدا کردن مقصر نزدیک شوند، وقت و پول بسیاری را هدر میدهند.
در کمال تعجب ، اداراتی که مسئولیت حفاظت از عموم مردم را در برابر آلاینده های سمی به عهده دارند، از شیوه دوم تبعیت میکنند. غالب قوانین زیست محیطی تنها مقدار ضایعاتی را که بالقوه خطرناکند، در آب و هوا کنترل میکنند، نه میزان تماس واقعی مردم با این آلاینده را.
تمرکزبه نشر به جای تماس واقعی
تمرکز بیشتر به نشر به جای تماس ، اساسا این واقعیت را که مواد سمی تنها در صورتی که به بدن برسند، برای سلامتی مشکل ایجاد میکنند، نادیده میگیرد.
این غفلت تا حدودی قابل درک است. برای مدتهای مدید ، اطلاعات کمی درباره میزان تماس بیشتر شهروندان در معرض آلودگیهایی که تحت پوشش مقررات ملی است، وجود داشت. قانون گذاری به ندرت عده افرادی را که آلاینده ای خاص بر آنها اثر میگذارد و شدت تاثیر یا منابع خاص ماده شیمیایی مضر را با قطعیت میشناختند. در نتیجه مقامهای مسئول غالبا روی محدود ساختن منابع آشکار ، مثل خودروها و کارخانهها ، متمرکز شدند و در شناسایی و تعیین بسیاری از منابع مهم که کمتر آشکارند، با شکست مواجه شدند.
خوشبختانه ، دانش ارزیابی میزان تماس افراد با مواد سمی پیشرفت کرده است. دانشمندان بویژه ، دستگاههای تجزیهای بسیار حساس و ابزارهای نمایشگر قابل حمل را ابداع کردهاند. پژوهشگران این تجهیزات را در مقیاس بزرگ بکار بردهاند تا نشان دهند که افراد در کجا و چگونه در معرض مواد شیمیایی بالقوه خطرناک واقع میشوند.
تماس شخصی
در سال 1980، اولین تلاش جدی برای برآورد تماس روزمره عموم مردم در معرض مواد سمی آغاز شد. این برنامه ، ابتدا به وسیله پژوهشگاه تری انگل در کارولینای شمالی و سایر سازمانهای پژوهشی پیمانکار انجام گرفت و سپس توسعه یافت و تا حدود بیست و چهار برنامه مطالعاتی را در 14 ایالت امریکا در برگرفت. پژوهشگران تحت حمایت بخش خصوصی با استفاده از همان روشها در ایالت پانزدهم (آلاسکا) و در یک استان کانادا ، مطالعات مشابهی انجام دادند.
در اغلب این بررسیها ، دستگاههای نمایشگر بکار میرفت. این دستگاهها آنقدر سبک و کوچک بود که افراد میتوانستند ضمن انجام فعالیتهای معمول خود ، آن را حمل کنند. این ابزارها نشان داد که چه آلودگیهایی و به چه مقدار در نزدیکی افراد وجود دارد. در پاره ای موارد ، پژوهشگران ، اندازهگیریهایی روی غذا و آب مصرفی نیز انجام دادند. آنها ، در مواردی ، مقدار آلاینده های مختلف خون را روی نمونههای تنفسی تعیین کردند.
این مطالعات ، فراوانی ترکیبات آلی فرار ، منوکسید کربن ، آفتکشها یا ذرات خطرناک را در زندگی روزمره بیش از 3000 نفر آزمود. این افراد در واقع بهعنوان نماینده جمعیتی بودند که در نواحی شهری و حومه آمریکای شمالی زندگی میکردند. نمونهها با جزئیات کافی تجزیه شیمیایی شدند تا مواد شیمیایی که افراد هر روزه در معرض آن هستند، مشخص شود.
بیشتر در این بررسیها ، ترکیبات فرار بویژه برای بررسی حدود 30 ماده شیمیایی مختلف که بسیاری از آنها عوامل شناخته شده سرطان در انسان و جانوراناند، آزمایش شد.
نتایج تحقیقات
اینکه تماسهایی که اغلب مردم با این مواد دارند، خطر بزرگی برای سلامتی آنها دارد یا خیر روشن نیست، زیرا تخمین حداقل مقدار لازم هر ترکیب برای آنکه باعث بیماری شود بسیار سخت است. هنوز هم نتایج مطالعات گیج کننده است: تماس اغلب شهروندان با آلاینده هایی که بالقوه سمیاند، در محیطهای بسته اساسا پاکیزه تصور میشوند، مثل منازل ، ادارات و خودروها و نه محیطهای باز ، خیلی محتمل است.
قرار گرفتن در معرض آلودگی در محیطهایی که معمولا مورد توجه قوانین زیست محیطیاند مثلا کارخانجات یا صنایع محلی در مقایسه قابل صرف نظر کردن است. حتی در شهرهای بایون و الیزابت در نیوجرسی که در آنها واحدهای فراورش شیمیایی زیادی وجود دارد، ثابت شده است که مقدار ترکیب آلی فرار در فضای بسته از فضای باز بیشتر است. مشخص شده است که منابع اصلی معمولا محصولات مصرفی ، از خوشبوکنندههای هوا ، پاککنندهها و انواع مصالح ساختمانیاند.
معضل آلودگی به بنزن در محیطهای بسته
آیا اقلامی که هرروزه بشر با خوشحالی وارد منازل خود می کند، بیش از آلودگیهای صنعتی برای سلامتی او مضرند، حتی در مورد اجتماعاتی که در محاصره واحدهای صنعتی هستند؟ پاسخ خیلی کوتاه ، بلی است. مثلا بنزن که غلظت زیاد آن در بدن ایجاد لوسمی (سرطان خون) میکند، در بنزین و بعضی محصولات خانگی وجود دارد. همچنین ، این ماده یکی از حدود 4000 ماده شیمایی است که در دود دخانیات یافت میشود، بنابراین زندگی با یک نفر سیگاری ، فرد را به مقدار زیاد در معرض بنزن قرار میدهد.
در سال 1985، پژوهشگران همه شواهد موجود را درباره آنکه چگونه چند صد نفر که در 5 ایالت مختلف بودند در معرض این ترکیب قرار گرفتند، جمع بندی کردند. ایشان دریافتند میانگین غلظت بنزنی که این افراد تنفس کرده بودند، نزدیک به سه برابر میزان آن در فضای باز بود. طبق محاسبات نزدیک به 45 درصد از کل تماس جمعیت آمریکا با بنزن ، از سیگار (یا تنفس دود سیگار دیگران) ، 36 درصد از تنفس بنزین یا مصرف انواع محصولات متداول (مثل چسب) و 16 درصد از سایر منابع خانگی (نظیر رنگها یا بنزین ذخیره شده در زیرزمینها یا توقفگاهها) ناشی میشود و تنها 3 درصد از میانگین میزان تماس افراد به آلودگی صنعتی نسبت داده میشود.
قانونگذاران به بیراهه می روند.
در مقابل ، قانونگذاری معمولا تنها به مقدار کل بنزنی که در محیط عمومی رها میشود، توجه میکنند که بیشترین سهم را در آن ، خودروها (82 درصد) ، صنعت (14 درصد) و منابع خانگی (3 درصد) دارند. سیگار تنها 1/0 درصد کل را شامل میشود. پژوهشگران نشان دادند که با قطع کامل نشر بنزن از واحدهای صنعتی این مشکل ابدا حل نمیشود. در حالیکه کاهش متوسط دود سیگار ( کوچکترین منبع بنزن در جو ) به میزان قابل ملاحظهای احتمال بیماریهای ناشی از بنزن را کم میکند.
سایر منابع عمده آلوده کننده
بسیاری دیگر از ترکیبات آلی فرار که در غلظتهای زیاد خیلی سمیاند، در محیطهای بسته فراوانتر از محیطهای بازند. مثلا تتراکلرو اتیلن (موسوم به پرکلرو اتیلن یا پرک) که مشخص شده عامل سرطان حیوانات آزمایشگاهی است، در خشک شوییها مصرف میشود. بنابراین وقتی مردم در ساختمانی که امکانات دارد، زندگی میکنند، لباسهایی را که اخیرا خشکشویی شده است، میپوشند یا لباسهای حاوی این ماده شیمیایی را در کمد خویش نگه میدارند، بیشترین حد تماس اتفاق میافتد.
مواد ضد بید ، ضدعفونی کنندههای توالتها و بوگیرها منابع اصلی تماس با پارادیکلرو بنزناند که در جانوران باعث سرطان میشود. مطالعات متافقا" نشان داده است که تقریبا همه تماس با پارادیکلرو بنزن از منبع داخل منزل ناشی میشود نه از نشر صنعتی یا زبالههای مضر.
راههای پیشگیری از تماس
با آنکه تخمین خطرهای سلامتی با قطعیت همراه نیست، روشن است که تماس کمتر با ترکیبات فرار سمی بهتر است، اغلب مردم میتوانند با اجتناب از محصولاتی که حاوی چنین آلودگیهاییاند، تماس با مواد بالقوه مضر را محدود کنند. اما اجتناب از سایر بخارهای مضر مشکل است. مثلا ، منابع اصلی تماس با کلروفرم (که گازی است نگران کننده ، زیرا در حیواناتی که در معرض غلظت زیاد آن قرار میگیرند سرطان ایجاد میکند) دوش آب ، آب جوش و مواد شوینده لباسهاست.
این ماده از کلری که برای تصفیه منابع آبی مصرف میشود، تشکیل میگردد. از آنجا که مردم ملزم به استفاده از آب لولهکشی هستند، تنها راه به حداقل رساندن تماس با کلروفرم ، نوشیدن آب بطری (یا آب شیر که از یک صافی زغالی مرغوب رد شده باشد) و بهبود تهویه در حمام و لباسشوییهاست.
پیشگیری از تماس با منوکسید کربن
جریان هوای خوب نیز میتواند به کاهش تماس با منوکسید کربن کمک کند. منوکسید کربن ، محصول احتراقی ناقص است، اکسیژن خون را کاهش میدهد و تنفس مقادیری از آن که معمولا در محیطهای بسته وجود دارد، بویژه برای افرادی که ناراحتی قلبی دارند، مضر است. با آنکه مطالعات انجام گرفته در اوایل دهه 1980 نشان میداد که مقدار کربن منوکسید در افراد درون وسایط نقلیه موتوری یا نزدیک به آنها به شدت افزایش مییابد، سایر تحقیقات نشان داد که لوازم خانگی ، مثل بخاریهای گازی با عملکرد ضعیف ، کبابپزها و کورهها نیز میتوانند باعث شرایط بسیار ناسالم- حتی مرگ - شوند.
خوشبختانه ، در آمریکا ، هماهنگ با کاهش مقدار نشر کربن منوکسید از خودروها که طبق قوانین فدرال انجام گرفت، مقدار آن در محیطهای باز نیز رو به کاهش گذاشت. پیشرفت بیش از این مشکل خواهد بود. زیرا در مجموع مردم آمریکا هماکنون در محیطهای بسته بیش از محیطهای باز در معرض کربن منوکسید قرار دارند.
خطر ذرات معلق
نگرانی زیست محیطی دیگری که در محیطهای بسته بیشتر است، خطر ذرات معلق در هواست. در یک بررسی ، پژوهشگران نمایشگرهای کوچکی را برای جمع آوری ذرات داخل و اطراف 178 منزل واقع در کنار رودخانه کالیف بکار بردند. نتایج نشان داد که ذرات با قطر 10 میکرون یا کمتر وجود دارند که برای نفوذ در ریه به قدر کافی کوچکند.
در عین ناباوری ، تماس روزانه ، از آنچه که با توجه به اندازه گیری همزمان مقدار ذرات معلق در نمونههای هوا در محیطهای بسته و باز انتظار میرفت، حدود 60 درصد بیشتر بود.
حداقل بخشی از این افزایش تماس به آن دلیل است که افراد در هوا شناورند نیستند، بلکه ابر غبار حامل ذرات محیط اطراف خود را ضمن حرکت جابه جا میکنند. این پژوهشگران نشان دادند که اکثر این ذرات ریز بر اثر احتراق (مثل سیگار ، پخت و پز ، سوختن شمع یا آتش چوب) تشکیل میشوند. پیدا شدن چنین آلایندههایی در محیطهای بسته مشکل آفرین است، زیرا مطالعات همه گیری شناسی اخیرا ارتباط افزایش غلظت ذرات ریز در محیطهای باز را با مرگ زودرس نشان داده است.
غلظت آفت کشها در محیطهای بسته
نتایج مطالعات آلاینده های محیطهای بسته که در اواخر دهه 1980 که در جکسون ویل و اسپرنیگ فیلد انجام گرفت، نگرانی بیشتری را موجب شد. بررسی کنندگان دریافتهاند که در این دو محل ، غلظت آفت کشها در هوای محیطهای بسته دست کم 5 برابر (نوعا 10 برابر یا بیشتر) از هوای باز بیشتر است و این حشره کشهایی را شامل میشود که مصرف آنها تنها در محیطهای باز مورد تایید است.
مواد شیمیایی که در پی ساختمان این منازل علیه موریانهها بکار رفته بود، به درون منازل راه یافته بود. این مواد سمی ممکن است از طریق کفش افراد یا از طریق خاک به شکل گاز وارد خانهها شده باشد. کلردان (در سال 1988 از فهرست محصولات مصرفی در منازل حذف شد) و سایر آفت کشها که هوای بسته را آلوده میکنند، بیش از آنچه که در مواد غذایی یافت میشوند، باعث تماس میشوند.
بعلاوه ، گاهی مردم ، آفت کشهای نامناسب را مستقیما روی سطوح محیطهای بسته بکار میبرند، بدون آنکه بدانند خودشان را تا حد زیادی در معرض آنها قرار میدهند. حتی خانهدارهای روشنفکر نیز غالبا بکار بردن مواد شیمیایی را خطرناک نمیدانند. آفت کشها که در محیط باز طی چند روز تخریب میشوند، ممکن است در قالبها که آنها را از تخریب به وسیله نور خورشید و باکتریها محافظت میکنند، سالها باقی بمانند. این پایداری را میتوان با اندازه گیری آفت کش د.د.ت (دی کلرودی فنیل تری کلرواتان) که در سال 1972 بدلیل سمی بودن ، مصرف آن در آمریکا ممنوع شد، نشان داد.
در بیش از نصف خانه هایی که بررسی شد، غلظت هفت ترکیب آلی سمی موسوم به هیدروکربنهای آروماتیک چند حلقهای (ترکیباتی که از احتراق ناقص حاصل شده و باعث سرطان در جانوران شده و تصور میشود که در انسان نیز سرطان بوجود میآورد)، بیش از مقدار مجاز در خاک نواحی پرجمعیت مسکونی بوده است.
انسان کوچک ، مشکلات بزرگ
آفت کشها و ترکیبات آلی فرار که در محیطهای بسته وجود دارند، هر ساله باعث 300 مورد سرطان در آمریکا میشوند، این مواد برای افراد غیر سیگاری به اندازه رادون (گاز پرتوزا طبیعی که از طریق پی وارد بسیاری از منازل میشود) یا دود غیر مستفیم سیگار تهدید کنندهاند. غبار سمی منازل بخصوص برای بچههای کوچک که کف خانه بازی میکنند، روی قالیها میخزند و مرتبا دستها را در دهان قرار میدهند، خطرناک است.
کودکان بسیار مستعدند، اندامهای در حال رشد آنها بیشتر آماده آسیب دیدگی است، آنها کسر کوچکی از وزن بدن بزرگسالان را دارند و ممکن است 5 برابر بیشتر از آنها غبار ببلعند، بطور متوسط 100 میلی گرم در روز.
تخمین تقریبی میزان آلودگی
قبل از سال 1990، زمانی که سازمان حفاظت از محیط زیست و وزارت مسکن و شهرسازی آمریکا روشهای استاندارد را برای نمونهبرداری غبار قالیها ، مبلمان و سایر سطوح تبیین کردند، برآورد کمی خطر موجود برای بچه ها مشکل بود. با این حال از آنوقت روشهای بهبود یافته به دانشمندان این امکان را دادند تا بیانی واقعی از میزان تماس ارائه کنند. مثلا ما هم اکنون قادریم تخمین بزنیم که هر کودک شهری بطور متوسط روزانه 110 نانوگرم بنزوپیرن ، سمیترین هیدروکربن آروماتیک چند حلقهای را میبلعد.
اگر چه به سختی میتوان با قطعیت گفت گه این مقدار چه اندازه احتمال ابتلای طفل به سرطان را در بعضی از نقاط بدن افزایش میدهد، ولی این مقدار هشدار دهنده بوده و با آنچه کودک میتواند از کشیدن سه نخ سیار بدست آورد، معادل است.
همچنین تحقیقات نشان داد که غبار خانگی برای بچهها منبع اصلی تماس با کادمیم ، سرب و سایر فلزات سنگین و همچنین پلیکلرو بیفنیلها و سایر آلاینده های آلی پایدار است. قالیها بیش از همه مشکل آفرینند، زیرا حتی اگر مرتب به روش متداول با جاروبرقی تمیز شوند، باز هم در عمقشان ترکیبات سمی (و همچنین باکتریهای خطرناک و حساسیت آورهای مولد آسم) عمل میکنند. قالبهای با پرز و موی بلند مشکلاتی بیش از قالبهای صاف دارند، کیفهایی که با چوب ، کاشی با مکالئوم پوشیده میشوند، بسیار آسان تمیز میشوند و مناسبند.
مقابله
بیرون آوردن کفش از پا ، پیش از ورود ، حتی بیش از پاک کردن کفش در کاهش مقدار آلاینده های سمی محیط داخل که محیط بیشتر منازل را آلوده میکند (مثل سرب رنگهای کنده شده و آفت کشهای خاک اطراف پی ساختمان) موثر است. افراد میتوانند با اعمال این نکات برای جلوگیری از ورود غبار و بکار بردن جاروبرقیهای موثر (انواعی که به برسهای گردان مجهزند و ترجیحا مجهز به حسگرهای غبار) ، مقدار سرب و بسیاری از مواد سمی دیگر را در قالیهایشان تا یکدهم (یا ، در بعضی موارد ، یک صدم) کاهش دهند.
ناآگاهی
بدبختانه بیشتر مردم از حضور همیشگی آلودگیها در فضای بسته و روشهای کاهش آن بیاطلاع اند. روش ابتکاری انجمن ریه آمریکا در پیدا کردن راه چاره آن است که داوطلبان آموزش دیده را به منازل بفرستد تا از منازل بازدید و به ساکنان آن در محدود ساختن خطرهای زیست محیطی خانگی ، کمک کنند.
مشکل با قانون
هماکنون یافتههای فراوانی از مطالعات چند جانبه درباره تماس روزانه مردم در اختیار است و همگی به یک نتیجه گیری اشاره میکنند که همان آلاینده های تحت پوشش قوانین زیست محیطی در فضای باز ، معمولا به میزان بیشتر در عموم اماکن مسکونی وجود دارند. این موقعیت ، دست کم تا حدودی نتیجه تلاش سه دهه اخیر در کنترل نشر از خودروها و صنایع در بهبود کیفیت هوای محیط باز بوده است.
از بین صدها آلاینده هوا که تحت کنترل قوانین جاری قرار دارند، تنها اوزون و گوگرد دیکسید در محیط باز بیشترند. بنابراین عجیب است که هنوز توجه بیشتری به آلودگیهای محیط بسته که تشخیص منابع اصلی آن مشکل نیست، معطوف نشده است. در واقع ، آنها درست زیر دماغ مردمند: ضدبیدها ، آفت کشها ، حلالها ، بوبرها ، پاک کننده ها ، لباسهای خشک شویی شده ، قالبهای غبار آلوده رنگ ، نئوپان ، چسبها و دود ناشی از پخت و پز و گرمایش تنها بعضی از این مواردند.
آموزش خروج از منزل در هنگام آتش سوزی
برخلاف فیلم های سینمایی و تلویزیونی، آتش واقعی ، روشن و شفاف نیست، دود آتش غلیظ و سیاه است. نمی توان دید که پشت صحنه آتش سوزی چه چیزهایی وجود دارد یا چه اتفاق هایی در حال وقوع است و در این میان گازهای سمی موجود در دود آتش ممکن است ما را گمراه کند اما اگر خمیده راه رفتن زیر سطح دود را تمرین کرده باشید و راه خروج خود را از کنار دیوارها و شمردن درها تا خروج از خانه پیدا کنید دقیقا خواهید دانست که چه کار باید انجام دهید و با آمادگی بیشتر از یک آتشسوزی واقعی خارج شده و جان سالم به در میبرید.
همه اعضای خانواده باید در مراحل تهیه نقشه فرار از آتش سوزی دخالت داشته باشند . حتی کودکان خردسال
نکاتی که در طرح فرار از خانه در هنگام بروز حادثه میبایست به آن توجه کرد :
- خانه را بگردید و دو راه فرار برای هر اتاق تعیین کنید، البته با اطمینان از اینکه هر یک از این خروجی ها در دسترس است، اگر هر اتاق دو راه دسترسی داشته باشد احتمال اینکه از آتش سوزی احتمالی در خانه خود نجات یابید افزایش می یابد.
- ببینید آیا پنجره ای وجود دارد که بسته است ولی باز نمی شود. پنجره ها حتما باید طوری باشد که بتوان آنها را باز کرده و زیر آن را کنترل نمایید آیا چیزی بیرون از پنجره وجود دارد که مانع از فرار شما شود یا در موقع خروج سبب آسیب دیدن شما شود ؟ اگر چنین است همین حالا مشکل را برطرف سازید.
- اگر پنجره های اتاق خواب شما دزدگیر دارد باید از داخل اتاق باز شود. اگر چنین نیست باید آنها را طوری تغییر دهید که از داخل باز شوند. دزدگیرها می تواند شما را در داخل اتاق خودتان محبوس کند همچنین طبق مقررات دزدگیرهای نصب شده روی پنجره اتاق خواب ها باید از داخل باز شود.
- اگر اتاق خواب های شما در طبقه دوم قرار دارد آیا پله های فرار برای هر اتاق خواب در نظر گرفته شده است؟
- مواظب باشید درها به وسیله مبلمان یا کمد مسدود نشده باشند.
- محل تجمع اعضا خانواده پس از خروج ازخانه را در محلی امن نسبت به خانه تعیین کنید.
- اگر افراد خردسال ، پیر یا ناتوان و معلول در خانه دارید اتاق خواب آنها را در طبقه همکف قرار داده و کسی را تعیین کنید تا در مواقع اضطراری به کمک ایشان بشتابد.
- ایست…
قبل از باز کردن در اندکی تامل کنید. در را لمس کنید. درحالی که دولا دولا راه میروید به طرف در رفته و تا آنجا که می توانید دست خود را بالا برده و در را لمس کنید بدون اینکه بایستید، شستی در لبه ها و پائین در را لمس کنید. اگر احساس کردید گرم هستند آن در را باز نکنید و از خروجی دیگر استفاده کنید.
- اگر در ضمن خروج، بوی دود را حس کردید از خروجی دیگر استفاده کنید اگر مجبور هستید از میان دود فرار کنید دولا دولا از زیر دود خارج شوید چون در آنجا هوا تمیزتر و خنک تر است.
- اگر لباستان آتش گرفت، حرکت نکنید، خودتان را روی زمین بیاندازید و روی زمین بغلتید و صورت خود را با دستانتان بپوشانید تا شعله ها خاموش شود.
- وقتی از خانه خارج میشوید دیگر هرگز به هیچ دلیل به خانهای که میسوزد برنگردید از منزل همسایه با سازمان آتش نشانی (125) تماس بگیرید.
تمرین کنید…
با تمرین کردن فرار از آتش می توانید سریع تر و با اضطراب کم تر از خانه خارج شوید اگر مسیر فرار خود را حفظ باشید می توانید به سرعت از منزل خارج شوید و دود و گاز حاصل از آتش شما را گمراه نخواهد کرد.
با رعایت این نکات ساده، خود و اعضای خانواده خود را در برابر آتش سوزی محافظت کنید :
- گاز سنج خود را امتحان کنید حداقل ماهی یک بار باتری های کهنه را با باتری های آلکالین نو و مرغوب تعویض کنید. گازسنج شما به مدت یک سال به خوبی کار می کند. اگر در منزل گازسنج ندارید همین امروز یکی از آنها را بخرید! در هر طبقه از منزل خود حداقل یک گازسنج نصب کنید از جمله در زیرزمین و اتاق نشیمن و از همه مهمتر بیرون همه اتاق خوابها ، گازسنج خود را طبق دستورالعمل سازنده آن نصب کنید. توجه داشته باشید گازسنج ممکن است تنها وسیله ای باشد که شما را به موقع هوشیار کند تا از آتش بگریزید.
- نقشه فرار از خانه را تهیه کنید تا در صورتی که آتش سوزی رخ دهد از مهلکه دور شوید. نقشه طبقات خانه را روی کاغذ رسم کرده و آن را به همه اعضای خانه تفهیم کنید. راه های خروجی را با دو خط مسیر که از درها و پنجره ها خارج می شوند مشخص کنید. محل تجمع پس از فرار از خانه را در جای امنی نسبت به خانه تعیین کنید تا همه اعضای خانواده در صورت بروز آتش سوزی در منزل بعد از نجات خود به آن مکان پناه آورند . دقت کنید که برای هر اتاق باید دو خروجی داشته باشید.
- نقشه فرار خود را به تمرین بگذارید . با دیگر اعضای خانواده نشسته و نقشه فرار خود را بررسی کنید پس از اینکه همه با نقشه آشنا شدند تمرین آتش سوزی را شروع کنید و از همه بخواهید روی تختخواب خود دراز بکشند و تکمه آزمون گازسنج را فشار دهید . به خاطر داشته باشید که قبل از باز کردن در باید آن را لمس کنید تا گرم نباشد ، همه دولا دولا شده و از خانه خارج شوند و در محل تجمع که از قبل تعیین شده در بیرون منزل منتظر بمانند. خطر مرگ برای کودکان در آتش سوزی منازل مضاعف است زیرا آنها اغلب در آتش سوزی می ترسند یا گیج می شوند دقت کنید که کودکان شما سیگنالهای گازسنج را درک کرده و آژیر آن را تشخیص دهند. در حالی که تمرین برای افراد بزرگسال ممکن است احمقانه جلوه کند اما کودکان از آن خوششان می آید و مزد واقعی این تمرین را در موقع قرار گرفتن در وضعیتی اضطراری خواهند گرفت.
- دزدگیرهای پنجره های اتاق خواب باید از داخل باز شوند اگر چنین نبود هر چه زودتر اقدام لازم معمول نمایید تا این پنجرهها با ضامن مناسب قابل عقب و جلو شدن باشند. شبکه هایی که درهای بیرونی را می پوشانند نیز باید به راحتی باز شوند برای درهای اتاق های مسکونی از ضامن های استوانه ای که دو کلید می خورند استفاده نکنید این نوع قفل ها وقتی قفل می شوند نیاز به یک کلید در داخل دارند تا باز شوند و اگر کلید را در جای آن قرار نداده باشید شاید نتوانید به سرعت آن را پیدا کنید.
- کبریت و فندک بازیچه دست کودکان نباید باشد این موارد را از دسترس کودکان دور نگهدارید.
- در مورد برق، احتیاط را رعایت کنید وقتی یک وسیله برقی روشن را در دست دارید روی سطح آب یا سطح مرطوب پا نگذارید. از وسایل یا سیم های رابط زخمی شده استفاده نکنید و آنها را جهت تعمیر ارسال نمایید یا دور بیاندازید. اگر احتمال می دهید که سیستم برق منزل شما اشکال دارد از افراد متخصص برای برطرف کردن عیب آنها کمک بخواهید. مشکلات برق از امور تخصصی است و میبایستی به متخصص آن واگذار شود.
- یک کپسول آتش نشانی را نصب کنید روی دیوار در مسیر خروجی یا مجاور آن به صورتی که در معرض دید باشد (ما نزدیک آشپزخانه را توصیه می کنیم). همچنین طرز کار با آن را یاد بگیرید.
- هرگز غذای در حال پختن را رها نکنید . بر روغن داغ به دقت نظارت کرده و آن را آهسته گرم کنید اگر مجبور هستید آشپزخانه را ترک کنید اجاق را خاموش کنید اگر روی اجاق ماهیتابه حاوی روغن آتش گرفت ، سر ماهی تابه را روی آن بگذارید تا شعله ها خفه شوند. همچنین میتوانید از کپسول آتش نشانی برای این کار استفاده کنید یا جوش شیرین در ماهی تابه بریزید هرگز از آب ، آرد یا نمک برای خاموش کردن چربی و روغن آتش گرفته استفاده نکنید.
- بنزین را در ظروف تائید شده نگهداری کنید و هیچ وقت بیش تر از دو گالن بنزین در خانه نگهداری نکنید. ظرف بنزین باید در برابر بخار نفوذناپذیر بوده و در یک کابینت در گاراژ یا بیرون از منزل دور از هر منبع حرارتی قرار داده شود هرگز بنزین را داخل خانه نگه ندارید. همچنین، بنزین را دور از دسترس کودکان نگه دارید.
- وسایل گرم کننده علت درجه یک آتش سوزی های خانگی است . دقت کنید که مواد قابل احتراق حداقل 60 سانتیمتر از بخاری های دیواری، بخاری های مبلی ، شومینه ها و تنورها دور باشند. هر سال شومینه یا دودکش منزل و محل کار خود را بازرسی و تمیز کنید. وقتی از اتاق خارج میشوید بخاری های دیواری را خاموش کرده و در موقع حضور در منزل به آنها توجه داشته باشید.
رنگ
تاریخچه
سابقه استفاده از مواد رنگی توسط انسان به دوران غارنشینی می رسد. اولین کاربرد واقعی و عملی مواد رنگی را می توان در ساختن کشتی نوح مربوط دانست که برای جلوگیری از نفوذ آب و پوسیدگی آن از مواد رنگی استفاده شده بود. بعدها از مواد رنگی برای حفاظت چوب از پوسیدگی در بناهای چوبی و زمانی که استفاده از وسایل آهنی متداول شد. برای جلوگیری از زنگ زدن آنها استفاده می شد .
اجزای تشکیل دهنده رنگ ها
هر رنگ اصولا از دو قسمت اصلی تشکیل شده است که عبارتند از:
رنگ دانه :
که ماده رنگی نامحلول در آن است ( خاک رس ناخالص رنگی و پودر برف از سنگهای رنگی به عنوان اولین رنگ دانه ها مورد استفاده انسان قرار می گرفتند ).
محمل رنگها:
مایعی است که با رنگ دانه مخلوط شده کاربرد آنرا آسان می کند و در چسبیدن آن کمک می کند ( از سفیده تخم مرغ چسب عسل محلول قند به عنوان محمل های رنگ استفاده می شد. امروزه متداول ترین محمل های رنگ دانه ها را آب یا روغن تشکیل می دهد. از اینرو رنگ ها را به دو دسته رنگهای روغنی و رنگهای آلی تقسیم می کنند.
انواع رنگ دانه ها
اکسید ها :
لیمونیت ( Fe2O3.2H2O ) برای تهیه رنگ قرمز مصرف می شود و یکی از قدیمی ترین رنگ دانه هاست.
هماتیت ( Fe2O3 ) برای تهیه رنگ قرمز روشن بکار می رود.
دی اکسید تیتان ( TiO2 ) برای تهیه رنگ سفید روشن و بسیار مرغوب که در هوا تیره نمی شود به کار می رود. معمولا آن را با سولفات باریم مخلوط می کنند.
ZnO که از مهم ترین رنگ دانه های سفید است و از تجزیه کربنات روی و یا سوزاندن فلز روی در هوا حاصل می شود.
سرنج ( Pb2O3 ) که رنگ سرخ یا قرمز تیره دارد و بیشتر برای پوشانیدن سطح قطعات فو لادی به منظور حفاظت آن ها از زنگ زدن ، کاربرد دارد.
سولفید روی و لیتوپن :
سولفید روی برای تهیه رنگ سفید مات مصرف می شود و از مزایای آن این است که بر خلاف سفید اب سرب در هوا سیاه نمی شود. این رنگ دانه معمولا در تجارت بصورت مخلوطی از سولفید روی و سولفات باریم به نام لیتوپن مصرف دارد که رنگ سفید بسیار مرغوب است.
سفید اب سرب :
این رنگ دانه عمدتا شامل Pb(OH)2 , pbCO3 که از قرن ها پیش شناخته شده بود . قدرت پوشش آن ها زیاد است ولی در هوا به علت وجود H2O به مرور سیاه می شود . برای تبدیل مجدد آن به رنگ سفید می توان از تاثیر پر اکسید هیدروژن بر آن استفاده کرد.
دوده چراغ و زغال استخوان :
یکی از اجزایی رنگ سیاه و مرکب است و برای تغییر رنگ سفید به میزان دلخواه نیز مصرف می شود.
رنگ دانه های فلزی :
مانند پودر آلومینیم در روغن جلا که که از آن برای حفاظت وسایل آهنی و فولادی استفاده می شود.
برنز آلومینیم ( آلیاژ AL,CU) در روغن جلا که از آن برای ایجاد رنگ بسیار زیبای طلایی برای دور قاب ها و ... استفاده می شود.
رنگ دانه های الوان :
رنگ دانه های آبی :
مهم ترین این این رنگ دانه ها آبی پروس و آبی نیلی یا لاجورد است. آبی پتروس که یکی از مهم ترین رنگ های آبی است . لاجورد نیز یکی از رنگ های آبی مرغوب است که از حرارت دادن مخلوط کائولین ، کربنات سدیم ، گوگرد و زغال سنگ در غیاب هوا حاصل می شود.
رنگ دانه های زرد :
مهم ترین این رنگ دانه ها کرومات روی و کرومات سرب است . از قطران زغال سنگ نیز رنگ دانه های الوانی بصورت نمک های نامحلول فلزات به دست می آید که در هیدروکسید آلومینین بصورت ژله می بندد. این ژله را پس از خشک کردن به صورت پودر با رنگ دانه های نظیر کربنات کلسیم و سیلسس مخلوط می کنند و در انواع رنگ های مورد نیاز به کار می برند.
رنگهای روغنی
در این نوع رنگها ، رنگ دانه را در یک روغن خشک شونده که استر گلیسیرین با اسیدهای چرب نظیر اسیدهای اولیک و یا لینولنیک می باشد حل می کنند. این روغنها در هوا اکسیده شده و به ترکیبات سیر شده تبدیل می شوند و لایهای سخت مقاوم و محافظ تشکیل می دهند که از نفوذ آب در رنگ دانه جلوگیری می کنند.
رقیق کننده :
برای رقیق کردن و سهولت کاربرد رنگ به کار می رود و معمولا یک حلال هیدرو کربنی نظیر ترپنتین است که به روغن تربانتین شهرت دارد.
خشک کننده :
یکی از اجزای رنگهای روغنی است که در حقیقت نقش کاتالیزور در تسریع اکسیداسیون و خشک شدن رنگ ها را دارد و معمولا مخلوطی از اکسید های سرب ، منگنز و کبالت در ( روغن بزرک )بصورت استر مصرف می شود.
رنگهای پلاستیکی
با اضافه کردن رزین های سنتزی نظیر رزین حاصل از فنل و فرمالدئید که خاصیت پلاستیکی دارد در روغن جلا رنگ های پلاستیکی حاصل می شود. این نوع رنگ ها به خاطر دوام و قابل شستشو بودن اهمیت و کاربردهای زیادی دارد.
رنگهای لعابی یا مات
با اضافه کردن رنگ هایی نظیر TiO2 به روغن جلا آن را به صورت مات درآورده و بعد برای مات کردن هر نوع رنگی به کار می رود .
رنگ اتومبیل
این نوع رنگ ها باید این ویژگی را داشته باشند که به سرعت در هوا خشک شوند. برای این منظور رنگ دانه را در حلال های آلی بسیار فرار نظیر استات آمیل ، استات اتیل یا استات بوتیل حل می کنند . برای رنگهای متالیک ( فلزی ) از رنگ دانه های فلزی استفاده می شود .
رنگهای محلول در آب
این نوع رنگ ها از معلق کردن رنگ دانه ها در آب مخلوط با یک چسب محلول در آب تهیه می شوند. از رنگهای روغنی ارزانترند و قابل شستشو نمی باشند .
رنگهای غیر شفاف در رنگ آمیزی چوب
عبارت است از مایع رنگینی که روی سطح چوب را می پوشاندکه این مایع رنگین پس از خشک شدن به شکل یک قشر سخت و غیر شفاف روی چوب باقی می ماند و به کلی نقش چوب را می پوشاند و تشخیص چوب را غیر ممکن می کند .رنگهای غیر شفاف خود به دسته های زیر تقسیم می شوند :رنگ روغنی: رنگ روغنی ترکیبی است از پودر رنگ، حلال، روغن جلا، اسکاتیف، مواد انعطاف دهنده و غیره است که به نوع پودر رنگ دارای رنگهای متفاوتی است.رنگ روغنی به دو دسته مات و براق تقسیم میشود.برای زدن رنگ روغنی لازم است سطح چوب را به روغن الیف آغشته و سپس با بتونه روغنی پر نموده و آن را رنگ نمود.حلال این نوع از رنگها تینر روغنی می باشد.از این رنگ برای مصارفی که در معرض رطوبت قرار می گیرند مانند: در و پنجره های ساختمان ، کابینت آشپز خانه و کلاً اشیای قابل شستشو استفاده می شود
انامل
نوعی جلای غیر شفاف است که بافت چوبی را مخفی می کند و در عوض رنگ مطلوبی به آن می دهد. انامل خیلی سخت و دارای قابلیت ارتجاعی خوبی می باشد. این جلا در مقابل تغییرات آب و هوایی مقاوم است.انامل را می توان به وسیله تینر رقیق کرد.
گاز سنتزی
اصطلاح گاز سنتز به مخلوطهای گازی اطلاق میشود که محتوی منوکسیدکربن و هیدروژن به نسبتهای مختلف باشند. هیدروژن و منوکسیدکربن دو مادة مهم در صنایع شیمیایی محسوب شده و دارای مصارف و کاربردهای فراوانی میباشند. منوکسیدکربن در تولید رنگها، پلاستیکها، فومها، حشرهکشها، علفکشها، اسیدها و ... به کار میرود. از جمله مصارف هیدروژن نیز میتوان به تولید آمونیاک، هیدروژناسیون و هیدروکراکینگ اشاره نمود.
گاز سنتز مادة اولیه بسیار با ارزشی جهت تولید مواد متنوع شیمیایی میباشد. با استفاده از این گاز و فرایندهای مختلف، میتوان مواد متنوع شیمیایی را تولید نمود که بسته به روش تولید آن نسبتهای مختلف هیدروژن به منوکسیدکربن به دست میآید. همچنین در موارد مصرف در صنعت، بسته به فرایندی که گاز در آن مورد استفاده قرار میگیرد، نسبتهای مختلف لازم است.
موارد مصرف گاز سنتز عمده موارد مصرف گاز سنتز به شرح ذیل است:
از آنجاییکه متانول به مقدار زیاد در سنتز استیک اسید مصرف میشود، اهمیت فراوانی در صنعت دارد.
در این نوع واکنشها از اولفینها با استفاده از گاز سنتز، آلدئید تولید میشود. این واکنش اکسو سنتز نیز نامیده میشود.
در این فرایند گاز سنتز به مولکولهای بنزینی در گستره تبدیل میشود. در اصل این واکنش اولیگومریزاسیون منوکیسدکربن به وسیلة هیدروژن جهت تشکیل محصولات آلی میباشد.
جهت احیای سنگ آهن به دست آمده از معادن، از گاز سنتز استفاده میشود در این فرایند آهن یا پودر آن به وسیله احیای مستقیم کانیهای آهن به دست میآیند.
از جمله دیگر مصارف گاز سنتز، میتوان به تهیه الکلهای سنگین، دیمتیل اتر، استرها، کتونها، هیدروکربورها و غیره اشاره کرد.
روشهای تهیة گاز سنتز
این روش، اولین روش تولید گاز سنتز است که در آن گاز سنتز توسط گازی شکل کردن کک از ذغال سنگ در دماهای پایین به وسیلة هوا و بخار آب به دست میآید:
این فرایند غیر کاتالیستی بوده و نسبت تولیدی توسط آن کم، و در حدود 1 است. با توجه به وجود مواد متنوع در ذغال سنگ، گاز سنتز تولیدی از این روش نیازمند واکنشها و خالصسازیهایی جهت تولید گاز سنتز با خلوص بالا میباشد.
این فرایند، غیرکاتالیستی بوده و در اصل احتراق جزئی هیدروکربن در حضور اکسیژن و بخار آب میباشد. موقعی که متان به عنوان خوارک مورد استفاده قرار گیرد، مزیت عمدة این روش که یک فرایند تولید گرما میباشد این است که طیف گستردهای از هیدروکربنها را به عنوان خوراک میتواند مورد استفاده قرار دهد. ترکیب گاز سنتز تولیدی بستگی به نسبت کربن به هیدروژن خوراک و مقدار بخار اضافه شده دارد.
این فرایند واکنش کاتالیستی هیدروکربن و عامل تغییر شکل دهنده (Reforming agent ) در دمای بالا میباشد. عامل تغییر شکل دهنده میتواند بخار آب، دیاکسید کربن، اکسیژن و یا مخلوط آنها باشد. ترکیب درصد گاز سنتز تولیدی بستگی به نوع هیدروکربن به کار رفته، عامل تغییر شکل دهنده و مقدار آن، شرایط عملیاتی و نوع کاتالیست دارد ۱- تهیة متانول ۲- تهیة اتیلن گلیکول ۳- واکنشهای هیدروفرمیلدار کردن ۴- سنتز فیشر- تروپش ۵- احیای سنگ آهن ۶- سایر مصارف 1- گازیشکلکردن زغال سنگ ۲- اکسیداسیون جزئی هیدروکربنها ۳- رفرمینگ هیدروکربنها
چگونگی کشف هیدروژن
هیدروژن یکی از جالب ترین عناصر جدول تناوبی است عدد اتمی اش یک و سبک ترین گاز موجود در طبیعت است عنصری است که برای حل بسیاری از مسائل شیمی نظری کشفش ضروری بوده عنصری است که با از دست دادن تنها الکترونش تبدیل به پروتونی عریان و به دون پوشش می شود و بنابراین شیمی هیدروژن شیمی ویژه ای است و در واقع شیمی یکی از ذرات اساسی است.
مندلیف هیدروژن را عادی ترین عنصر درمیان عناصر عادی می نامد (وی عناصر موجود در تناوبهای کوتاه جدول تناوبی را عادی تلقی می کرد) زیرا این عنصر آغازگر سری عناصر شیمیایی طبیعی بود می توان با واکنش ساده مانند ریختن اسید کلرئیدریک بر روی براده روی مقداری هیدروژن تهیه کرد.
حتی در دورانهای کهن که هنوز شیمی به عنوان علم تلقی نمی شد و کیمیا گران در جستجوی کیمیا بودند اسید کلرئیدریک، اسید سولفوریک،اسید نیتریک،آهن وروی ، شناخته شده بودند به عبارت دیگر بشر کلیه موادی را که با اثر دادنشان بر هم می توانست هیدروژن تهیه کند در اختیار داشت . تنها برای شناختن آن می بایستی واقعه ای رخ دهد . در نوشته های قرنهای دهم تا دواردهم شمسی / شانزدهم تا هیجدم میلادی گزارشهایی موجود است که نشان می دهد در برخی موارد مانند ریختن اسیدسولفوریک بر روی براده آهن گازی متساعد می شده است که در آن زمان تصور می شد که نوعی هوای قابل اشتعال است . یکی از کسانی که به این نوع هوای اسرار آمیز برخورده است لومونوزوف دانشمند مشهور روسی بوده است . در سال 1124/ 1745 وی رساله ای تحت عنوان « درباره درخشندگی فلزی» نوشت که از جمله مطالبش یکی این بود که :« با حل کردن برخی فلزات پست ، به ویژه آهن ، در الکل اسیدی شده ،بخارات قابل اشتعال از دهانه باز دستگاه آزمایش خارج می شود .... (بنابر اصطلاحات متداول آن زمان ، اسید را الکل اسیدی شده می نامند ) بنابراین ، آنچه که لومونوزوف دیده بود چیزی جز هیدروژن نبوده است . ولی اگر جمله اش را تا آخر بخوانیم ، می بینم که نوشته است ... این بخارات فلوژیستون است . نظر به اینکه انحلال فلز در اسید موجب تولید materia ignea یا بخاری قابل اشتعال می شد ، خیلی مناسب بود که آن را به اینگونه تفسیر کنند که انحلال فلز ، سبب آزاد شدن فلوژیستون می شود . با این عبارت پردازی ، واکنش مزبور منطبق بر « نظریه آتش زایی » می شود . اینک به جا است که با کاوندیش دانشمند ارزنده انگلیسی آشنا شویم وی با تعصب عجیبی به علم گرایش داشت و آزمایشگر برجسته ای بود . وی هرگز در انتشار نتایج تجربه هایش عجله نداشت و گاه سالها می گذشت تا مطلبی منتشر کند بنابراین مشکل است بتوان به طور دقیق معلوم کرد که وی آزاد شدن « هوای قابل اشتعال» را در چه تاریخ مشاهده کرده است .
نکته ای که در این مورد معلوم است ، انتشار مطلبی در سال 1145 شمسی / 1766 میلادی تحت عنوان «آزمایشهایی با هوایی مصنوعی» بود که یکی از موضوعات اساسی را در پژوهش های شیمی هوایی تشکیل داد . در عین حال به نظر می رسد که آن تجربیات بر اثر پافشاری بلاک انجام شده باشد . « هوای ثابت » توجه کاوندیش را جلب کرده بود و در نتیجه وی تصمیم گرفته بود ببیند آیا نوع دیگری از هوای مصنوعی وجود دارد یا خیر . در این بررسیها او اشاره به نوع دیگری از هوا می کرد که در ترکیبات وجود دارد و به طور مصنوعی قابل جدا کردن از آنها است . ولی می دانست که هوای قابل اشتعال را درموارد متعدد دیده اند و خودش هم به همان روش یعنی اثر دادن اسید سولفوریک و اسید کلرئیدریک بر آهن ، روی و قلع ، به تهیه آن مبادرت ورزید . با انجام این آزمایشها ،وی نخستین فردی بود که ثابت کرد که در همه موارد یاد شده نوع مشابهی هوا یعنی «هوای قابل اشتعال » را مورد توجه قرار می گیرد . کاوندیش به عنوان پیرو «نظریه آتش زایی » تنها به یک نوع تفسیر در باره طبیعت ماده اعتقاد داشت . بنابراین او هم مانند لومونوزوف، این ماده را فلژیستون نامید . وقتی وی درباره خواص «هوای قابل اشتعال » بررسی می کرد ، مطمئن بود که مشغول بررسی خواص «فلژیستون » است . او ضمن کارهایش به این نتیجه رسیده بود که فلزات مختلف ، حاوی نسبت های مختلفی از «هوای قابل اشتعال » هستند .بنابراین به «هوای ثابت »مورد اداعای بلاک ، «هوای قابل اشتعال » کاوندیش هم اضافه شد . به طور خلاصه آن دو دانشمند چیز تازه ای کشف نکرده اند و فقط توانستند مشاهدات گذشتگان را جمع بندی کنند . اما همین جمع بندیها سبب پیشرفت چشمگیری در تاریخ دانش بشری شد .«هوای ثابت » و «هوای قابل اشتعال» با یکدیگر و با هوای معمولی تفاوت داشتند.«هوای قابل اشتعال » به طور اعجاب آور سبک وزن بود .کاوندیش متوجه شد که فلوژیستونی که به دست آورده است ، دارای جرم است. وی نخستین فردی بود که کمیت چگالی را برای اندازه گیریهای مربوط به گازها معرفی کرد . وقتی چگالی هوا را برابر واحد فرض کرد ، برای چگالی «هوای قابل اشتعال» مقدار 9./. و برای چگالی «هوای ثابت » مقدار 75/1 بدست آورد . اما در اینجا میان کاوندیش تجربه گر و کاوندیش طرفدار «نظریه آتش زایی» اختلاف بروز کرد زیرا با توجه به این که «هوای قابل اشتعال » دارای جرم است ،به همین وجه نمی توان آن را فلوژیستون خالص تلقی کرد .به عبارت دیگر فلزاتی که هوای قابل اشتعال را از دست می دهند ، اجبارا باید دستخوش کم شدن جرم هم بشوند کاوندیش برای رفع این تناقض ، فرضیه ای بی محتوا به این شرح ابراز داشت :«هوای قابل اشتعال » مجموعه ای از فلوژیستون و آب است . حاصل آن فرضیه این بود که بلاخره در ترکیب «هوای قابل اشتعال » هیدروژن ظاهر شد .
نتیجه آشکار این است که گر چه کاوندیش «هوای قابل اشتعال »را وزن کرد ، خواصش را شرح داد و آن را نوع ویژه ای از «هوای مصنوعی » دانست ،ولی او هم مانند پیشینیانش به ماهیت این ماده پی نبرد . به عبارت دیگر کاوندیش به دون آگاهی از واقیعت ماده ای را که به دست آورده بود به عنوان فلوژیستون مورد مطالعه قرار داد ، نه به عنوان عنصر شیمیایی جدید و علت این اشتباه ، پایبند بودنش به «نظریه آتش زایی » بود . وقتی وی متوجه شد که خواص «هوای قابل اشتعال » مغایر با آن نظریه است «فرضیه ای که به اندازه نظریه گفته شده گمراه کننده بود ، ارائه داد.
بنابراین اگر بگوییم «هیدروژن را کاوندیش دانشمند انگلیسی در سال 1145 /1766 کشف کرده است» ، حرف نادرستی زده ایم . درمقایسه با دیگران ، کاوندیش روشهای تهیه و نیز خواص « هوای قابل اشتعال » را با جزئیات بیشتری شرح داده است . در هر حال ولی در عین حال نمی دانست چکار می کند و طبیعت عنصری هوای قابل اشتعال بر او روشن نشده بود . ولی نمی توان گناه را به گردن این دانشمند گذاشت ، بلکه باید گفت که شیمی هنوز به آن درجه از کمال که چنین پیشبینیهایی داشته باشد ،نرسیده بود . سالها گذشت تا سرانجام هیدروژن واقعا هیدروژن شد و جای شایسته اش را در شیمی اشغال کرد نام لاتین آن hydrogcnium از دو کلمه یونانی hydro وgcnnac به معنی « آبزا » گرفته شده است . این نام را لااووازیه درسال 1158 / 1779 پس از معلوم شدن ترکیب آب ،پیشنهاد کرد . حرفH به عنوان علامت شیمیاییش توسط برزلیوس پیشنهاد شده است . هیدروژن از جهت اینکه ایزوتوپهایش هم از نظر خواص فیزیکی با هم متفاوتند و هم از نظر خواص شیمیایی ، عنصری منحصر به فرد است . زمانی این تفاوت ها برخی دانشمندان را واداشت که ایزوتوپهای هیدوژن را به عنوان عناصر جداگانه ای تلقی کنند و برایشان جای ویژه ای در جدول تناوبی پیدا کنند .بنابراین تاریخچه کشف ایزوتوپهای هیدروژن همانند تاریخچه خود هیدروژن جالب توجه است .
جستجوی ایزتوپهای هیدروژن در دهه اول قرن حاضر شمسی /دهه سوم قرن حاضر میلادی آغاز شد ولی همه کوششها ناکام ماند و نتیجه گیری کردند که هیدروژن ایزوتوپ ندارد . در سال 1310/ 1931 پیشنهاد شد که هیدروژن باید دارای ایزوتوپی به عدد جرمی 2 باشد . نظر به اینکه چنین ایزوتوپی جرمش دو برابر هیدروژن است ، دانشمندان برای جدا کردن هیدروژن سنگین به روشهای فیزیکی متوسل شدند. در سال 1311 /1932 سه نفر دانشمند آمریکایی به نامهای یوری ، بریکود و مورفی هیدروژن مایع را تبخیر کردند و با مطالعه باقی مانده تبخیر به روش طیف سنجی ،ایزوتوپ سنگین را در آن یافتند .وجود هیدروژن سنگین در هوای جو در سال 1320/1941محقق شد.نام دوتریوم deuterium از کلمه یونای deuteron به معنی «دومین یا یکی دیگر » گرفته شده است . ایزتوپ دیگر با عدد جرمی سه به نام تری تیوم( مشتق از کلمه یونانی tritos به معنی سومین ) رادیواکتیو است و در سال 1313 /1934 توسط سه دانشمند انگلیسی به نامهای اولیفانت ،هارتک و رادرفوردشناخته شده است . به ایزوتوپ اصلی هیدروژن نام پروسیوم نیز داده اند .این تنها موردی از که ایزوتوپهای یک عنصر نامها و علامتهای شیمیایی متفاوت دارند (hوt و d ).99/99 درصد همه هیدروژنها از پروسیوم است و بقیه اش دوتریوم می باشد . به صورت اثر بسیار ناچیزی همواره دو ایزوتوپ دیگر است .
نانوتکنولوژی و صنعت نفت
نانوتکنولوژی و صنعت نفت
فناوری نانو میتواند اثرات قابل توجهی در صنعت نفت داشته باشد، در مطلب زیر بعد از اشاره به برخی از این تأثیرات، تعدادی از کاربردهای فناوری نانو در صنعت نفت بویژه در بحث آلودگی محیط زیست و نیز سنسورهای نانو به طور مختصر معرفی گردیده است:
مقدمه هنگامی که ریچارد اسملی ( Richard Smally ) برندة جایزة نوبل، بالک مینسترفلورسنس را در سال 1985 در دانشگاه رایس کشف نمود، انتظار اندکی داشت که تحقیق او بتواند صنعت نفت را متأثر سازد. سازمان انرژی آمریکا ( DOE ) سرمایهگذاری خود را در قسمت فناوری نانو با 62 درصد افزایش داد تا مطالعات لازم در زمینة موادی با نامهای باکیبالها ( Bulky Balls ) و باکیتیوبها ( Bulky Tubes ) استوانههای کربنی که دارای قطر متر میباشند صورت گیرد. نانولولههای کربنی با وزنی در حدود وزن فولاد، صد برابر مستحکم تر از آن بوده، دارای رسانش الکتریکی معادل با مس و رسانی گرمایی هم ارز با الماس میباشند. نانوفیلترها میتوانند به جداسازی مواد در میدانهای نفتی کمک کنند و کاتالیستهای نانو میتوانند تأثیر چندین میلیارد دلاری در فرآیند پالایش بهدنبال داشته باشند. از سایر مزایای نانولولههای کربنی میتوان به کاربرد آنها در تکنولوژی اطلاعات ( IT ) نظیر ساخت پوششهای مقاوم در مقابل تداخلهای الکترومغناطیسی، صفحههای نمایش مسطح، مواد مرکب جدید و تجهیزات الکترونیکی با کارآیی زیاد اشاره نمود.
علم نانو یک تحول بزرگ در مقیاس بسیار کوچک
بسیاری از محققان و سیاستمداران جهان معتقدند که علم نانو میتواند تحولات اساسی در صنعت جهانی ایجاد نماید صنعت نفت نیز از پیشرفت این تکنولوژی بهرهمند خواهد گشت.
علم نانو میتواند به بهبود تولید نفت و گاز با تسهیل جدایش نفت وگاز در داخل مخزن کمک نماید. این کار با درک بهتر فرآیندها در سطوح مولکولی امکانپذیر میباشد. با توجه به اینکه نانو مربوط به ابعادی در حدود متر میباشد، نانوتکنولوژی به مفهوم ساخت مواد و ساختارهای جدید توسط مولکولها و اتمها در این مقیاس میباشد.
خوشبختانه کاربردهای عملی نانو در صنعت نفت جایگاه ویژهای دارند. نانوتکنولوژی دیدگاههای جدید جهت استخراج بهبودیافتة نفت فراهم کرده است. این تکنولوژی به جدایش موثرتر نفت و آب کمک میکند . با افزودن موادی در مقیاس نانو به مخزن میتوان نفت بیشتری آزاد نمود. همچنین میتوان با گسترش تکنیکهای اندازهگیری توسط سنسورهای کوچک، اطلاعات بهتری دربارة مخزن بدست آورد.
مواد نانو
صنعت نفت تقریباً در تمام فرآیندها احتیاج به موادی مستحکم و مطمئن دارد. با ساخت موادی در مقیاس نانو میتوان تجهیزاتی سبکتر، مقاومتر و محکمتر از محصولات امروزی تولید نمود. شرکت نانوتکنولوژی GP در هنگکنگ یکی از پیشگامان توسعة کربید سیلیکون، یک پودر سرامیکی در ابعاد نانو میباشد.
با استفاده از این پودرها میتوان مواد بسیار سختی تولید نمود. این شرکت در حال حاضر مشغول مطالعه و تحقیق بر روی سایر مواد مرکب میباشد و معتقد است که میتوان با نانوکریستالها تجهیزات حفاری بادوامتر و مستحکمتری تولید کرد. همچنین متخصصان این شرکت یک سیال جدید حاوی ذرات و نانوپودرهای بسیار ریز تولید نمودهاند که بهطور قابل توجهی سرعت حفاری را بهبود میبخشد. این مخلوط آسیبهای وارده به دیوارة مخزن در چاه را حذف نموده و قابلیت استخراج نفت را افزایش میبخشد.
آلودگی
آلودگی توسط مواد شیمیایی و یا گازهای آلاینده یک مبحث بسیار دشوار در تولید نفت و گاز میباشد. نتایج بدستآمده از تحقیقات دانشمندان حاکی از آن است که نانوتکنولوژی میتواند تا حد مطلوبی به کاهش آلودگی کمک کند. در حال حاضر فیلترها و ذراتی با ساختار نانو در حال توسعه میباشند که میتوانند ترکیبات آلی را از بخار نفت جدا سازند. این نمونهها علیرغم اینکه اندازهای در حدود چند نانومتر دارند، دارای سطح بیرونی وسیعی بوده و قادر به کنترل نوع سیال گذرنده از خود میباشند. همچنین کاتالیستهایی با ساختار نانو جهت تسهیل در جداسازی سولفید هیدروژن، آب، مونوکسیدکربن، و دیاکسید کربن از گازطبیعی در صنعت نفت بکار گرفته میشوند. در حال حاضر مطالعاتی بر روی نمونههایی از خاک رس در ابعاد نانو و جهت ترکیب با پلیمرهایی صورت میپذیرد که بتوانند هیدروکربنها را جذب نمایند. بنابراین میتوان باقیماندههای نفت را از گل حفاری جدا نمود.
سنسورهای هیدروژن خود تمیز کننده
خواص فوتوکاتالیستی نانوتیوبهای تیتانیا در مقایسه با هر فرمی از تیتانیا بارزتر میباشد، بطوریکه آلودگیهای ایجادشده تحت تابش اشعة ماوراء بنفش بهطور قابل توجهی از بین میروند. تا اینکه سنسورها بتوانند حساسیت اصلی خود نسبت به هیدروژن را حفظ نماید. تحقیقات انجامگرفته در این زمینه حاکی از آن است که نانوتیوبهای تیتانیا دارای یک مقاومت الکتریکی برگشتپذیر میباشند، بطوریکه اگر هزار قطعه از آنها در مقابل یک میلیون اتم هیدروژن قرار بگیرند، مقاومت الکتریکی آن در حدود یکصد میلیون درصد افزایش مییابد.
سنسورهای هیدروژن بطور گستردهای در صنایع شیمیایی، نفت و نیمهرساناها مورد استفاده قرار میگیرند. از آنها جهت شناسایی انواع خاصی از باکتریهای عفونتزا استفاده میگردد. به هر حال محیطهایی نظیر تأسیسات و پالایشگاههای نفتی که سنسورهای هیدروژن از کاربردهای ویژهای برخوردار میباشند، میتوانند بسیار آلوده و کثیف باشند این سنسورهای هیدروژن نانوتیوبهای تیتانیا هستند که توسط یک لایة غیرپیوستهای از پالادیم پوشانده شدهاند. محققان این سنسورها را به مواد مختلفی نظیر اسید استریک ( یک نوع اسید چرب )، دود سیگار و روغنهای مختلفی آلوده نمودند و سپس مشاهده کردند که تمام این آلودهکنندهها در اثر خاصیت فوتوکاتالیستی نانوتیوبها از بین میروند. حد نهایی آلودگیها زمانی بود که دانشمندان این سنسورها را در روغنهای مختلفی غوطهور ساخته و سنسورها توانستند خواص خود را بازیابند. محققان سنسورها را در دمای اتاق به مقدار هزار قطعه در مقابل یک میلیون اتم هیدروژن در معرض این گاز قرار دادند و مشاهده نمودند که در طرحهای اولیة سنسور مقاومت الکتریکی آن به میزان 175000 درصد تغییر میکند. سپس سنسورها را توسط لایهای به ضخامت چندین میکرون از روغن موتور پوشاندند تا بطور کلی حساسیت آنها نسبت به هیدروژن از بین برود. سپس این سنسورها را در هوای عادی به مدت 10 ساعت در معرض نور ماوراء بنفش قرار دادند و پس از یک ساعت مشاهده نمودند که سنسورها مقدار قابل توجهی از حساسیت خود را بدست آورده و پس از گذشت 10 ساعت تقریباً بطور کامل به وضعیت عادی خود بازگشتند.
علیرغم قابلیت بازگشتی بسیار مناسب این سنسورها نمیتوانند پس از آلودگی به انواع خاصی از آلودهکنندهها حساسیت خود را باز یابند برای مثال روغن WQ -40 به علت دارابودن مقداری نمک خاصیت فوتوکاتالسیتی نانوتیوبها را تا حد زیادی از بین میبرد.
با افزودن مقدار اندکی از فلزات مختلف نظیر قلع، طلا، نقره، مس و نایوبیم، یک گروه متنوعی از سنسورهای شیمیایی بدست میآیند. این فلزات خاصیت فوتوکاتالیستی نانوتیوبهای تیتانیا را تغییر میدهند. به هر حال سنسورها در یک محیط غیرقابل کنترل در دنیای واقعی توسط مواد گوناگونی نظیر بخارهای آلی فرار، دودة کربن و بخارهای نفت و همچنین گرد و غبار آلوده میگردند. قابلیت خودپاککنندگی این سنسورها طول عمر آنها را افزایش و از همه مهمتر خطای آنها را کاهش میدهد.
سنسورهای جدید در خدمت بهبود استخراج نفت
براساس آخرین اطلاعات چاپ شده توسط سازمان انرژی آمریکا، استخراج نفت در حدود دو سوم از چاههای نفت آمریکا اقتصادی نمیباشد. با توجه به دما و فشار زیاد در محیطهای سخت زیرزمینی، سنسورهای قدیمی الکتریکی و الکترونیکی و سایر لوازم اندازهگیری قابل اعتماد نمیباشند و در نتیجه شرکتهای استخراج کنندة نفت در تهیة اطلاعات لازم و حساس جهت استخراج کامل و مؤثر نفت از مخازن با برخی مشکلات مواجه میباشند.
در حال حاضر محققان در آزمایشگاه فوتونیک دانشگاه صنعتی ویرجینیا در حال توسعة یکسری سنسورهای قابل اعتماد و ارزان از فیبرهای نوری جهت اندازهگیری فشار، دما، جریان نفت و امواج آکوستیک در چاههای نفت میباشند. این سنسورها بهعلت مزایایی نظیر اندازة کوچک ،ایمنی در قبال تداخل الکترومغناطیسی ، قابلیت کارآیی در فشار و دمای بالا و همچنین محیطهای دشوار، مورد توجه بسیار قرار گرفتهاند. از همه مهمتر اینکه امکان جایگزینی و تعویض این سنسورها بدون دخالت در فرآیند تولید نفت و باهزینة مناسب فراهم میباشد. در حال حاضر عمل جایگزینی و تعویض سنسورهای قدیمی در چاههای نفت میلیونها دلار هزینه در پی دارد. سنسورهای جدید از نظر تولید بسیار مقرون به صرفه بوده و اندازهگیریهای دقیقتری ارائه میدهند.
انتظار میرود که تکنولوژی این سنسورها تولید نفت را با ارائه اندازهگیریهای دقیق و قابل اعتماد و کاهش ریسکهای همراه با اکتشاف و حفاری نفت بهبود بخشد. همچنین سنسورهای جدید بهعلت برخی کاربردهای ویژه نظیر استخراج دریایی و افقی نفت، جایی که بکاربستن سنسورهای قدیمی در چنین شرایطی بسیار مشکل میباشد، از توجه ویژهای برخوردارند.
درجه پیچیدگی پالایشگاه و ارزش افزوده فراوردهها
انواع پالایشگاه از نظر پیچیدگی
میزان سوددهی یک پالایشگاه، به عوامل زیر بستگی دارد:
“قیمت نفتخام و در دسترسبودن آن”، “خصوصیات بازار منطقهای”، “ظرفیت فرایندهای پالایشگاه”، “درجه پیچیدگی” و “کارآیی پالایشگاه”. انتخاب درجه پیچیدگی مناسب برای یک پالایشگاه، با توجه به این عوامل تعیین میگردد. پالایشگاهها از نظر پیچیدگی به چهار نوع زیر تقسیم میشوند:
۱/ ساده (Topping)
در این پالایشگاه نفتخام توسط تقطیر اتمسفری، تنها به اجزای تشکیلدهندهاش تبدیل میشود. محصول آن نفتا است و بنزین تولید نمیکند.
۲/ Hydroskimming
این نوع پالایشگاه به واحد تقطیر اتمسفری و واحد تغییر شکل نفتا (Reforming) مجهز است. از نوع ساده پیچیدهتر است و بنزین تولید میکند. اما مقدار زیادی سوخت کمارزش که تقاضا برای آن کم است، نیز تولید میکند.
۳/ Cracking
علاوه بر واحدهای ذکر شده در انوع ۱ و ۲ ، شامل واحد تقطیر خلأ و واحد شکست کاتالیستی (FCC) نیز میباشد. نسبت به نوع ۲، یک درجه پیچیدگی بیشتری دارد. تولید نفت کوره در آن کاهش یافته و تبدیل آن به فرآوردههای تقطیر سبک و میانتقطیر انجام میشود.
۴/ Coking
این پالایشگاه مجهز به فرایندDelayed Coking است که قبل از فرایند شکست کاتالیستی انجام میشود. درجه بالای تبدیل نفت کوره به فراوردههای تقطیر و کک نفت باعث میشود نسبت به انواع قبلی بالاترین پیچیدگی را داشته باشد.
برای نشان دادن میزان پیچیدگی یک پالایشگاه، از ضریب پیچیدگی نلسون استفاده میکنند که این ضریب برای پالایشگاه Hydroskimming، در حدود ۲، برای پالایشگاه Cracking تا ۵ و برای نوع Coking بالاتر از ۹ تعیین شدهاست.
ضریب پیچیدگی پالایشگاه، اطلاعاتی راجع به پیچیدگی پالایشگاه، هزینههای جایگزینی و توانایی ارزشافزوده یک پالایشگاه در اختیار قرار میدهد؛ ضمن اینکه میتوان براساس آن پالایشگاههای مختلف را طبقهبندی کرد.
معرفی فرایندهای پالایش
نوع فرایندهای مورد استفاده در پالایشگاه، در تعیین پیچیدگی آن مؤثر است و هر اندازه واحدهای تبدیل ثانویه یک پالایشگاه، بیشتر باشند درجه پیچیدگی آن نیز بیشتر خواهد بود. در زیر واحدهای تبدیل اولیه و ثانویه و انواع آنها معرفی میشوند:
الف) فرایندهای تبدیل اولیه (Primary Conversion Processes)
1. تقطیر اتمسفری
ابتداییترین فرایند در پالایشگاه، جداسازی ترکیبات تشکیلدهنده نفت خام در فشار اتمسفر است که توسط حرارت و سپس متراکم کردن آن با سردکردن انجام میشود. این فرایند در واحد CDU یا Conversion Distillation Unit انجام میگیرد.
۲/ تقطیر در خلأ
واحد تقطیر در خلأ (VDU) عمل جداسازی ترکیبات نفتخام را به اجزای تشکیلدهنده، در فشاری پایینتر از فشار اتمسفری انجام میدهد که در این صورت از تغییر شکل کک جلوگیری میشود.
ترکیبی از این دو واحد فرایند (VDU/CDU) نیز برای جداسازی نفتخام به ترکیبات اولیه بهکار میرود که محصولات آن LPG، نفتا، کروزن، نفتگاز، نفتگاز خلأ و تهمانده ستون تقطیر خلأ میباشد.
ب) فرایندهای تبدیل ثانویه Secondary Conversion Processes
فرایندهایی هستند که روی محصولات حاصل از ستونهای تقطیر مانند نفتکوره و نفتا انجام میشوند و محصولات سبکتر و با ارزشافزوده بالاتر تولید میکنند.
۱/ آلکیلاسیون (Alkylation)
این فرایند برای ترکیب شیمیایی ایزوبوتان با هیدورکربنهای اولفینی سبک (از نوع c4و c3)، در حضور کاتالیست اسیدی بهکار میرود. محصول این فرایند آلکیلات (Alkylate)، یکی از بهترین ترکیباتی است که میتواند برای بهسوزی بنزین به آن اضافه شود؛ زیرا یک سوخت تمیز، با محتوی سولفور کم و فاقد ترکیبات اولفینی و آروماتیکی است ضمن اینکه عدد اکتان بالا و فشار بخار پایین هم از خصوصیات آن میباشد.
از منظر دیگر، اولفینهای C3 و C4 برای تولید LPG یا Petroleum Gas Liquified نیز کاربرد دارند. از اینرو در مناطقی که تقاضا برای LPG بیشتر از مصرف بنزین باشد، فرایند آکلیلاسیون رایج نیست.
۲/ فرایند ” Bottam of the Barrel ”
مجموعه فرایندهایی است که روی مواد تهمانده ستون تقطیر خلأ با نقطهجوش بالا (ºc565)، محتوی سولفور زیاد و حاوی قیرمعدنی و فلزاتی که در نفت کوره صنعتی یا سنگین یافت میشود انجام میشود؛ اهمیت آن از این جهت است که کاربرد نفت کوره بهدلیل محدودیتهای میزان انتشار Sox و Nox بهشدت در حال کاهش است. چندین روش برای انجام این عمل وجود دارد که شامل فرایندهای زیر است:
Delayed Cracking (1
Visbreaking (2
Resid Desulfurization (3
در ادامه به توضیحات بیشتر درباره آنها نیز میپردازیم.
۳/ شکست کاتالیستی (Catalytic Cracking)
در طی این فرایند مولکولهای هیدروکربن پیچیده، سنگین و بزرگ توسط حرارت و در حضور کاتالیست (بدون افزودن هیدروژن) به مولکولهای سادهتر و سبکتر شکسته میشوند. با اعمال این فرایند، نفت سنگین (از اجزای تشکیلدهنده نفت کوره) به محصولات با ارزشتر مثل LPG، بنزین و فراوردههای میانتقطیر تبدیل میشود. کاربرد این فرایند که اختصاراً با نام FCC یا Catalytic Cracking Fluidized شناخته میشود، در فرایندهای تبدیل ثانویه پالایش گسترده است.
واحدهای FCC، براساس دو الگوی “حداکثر تولید بنزین” و “حداکثر تولید فراوردههای تقطیری” عمل میکنند که انتخاب یکی از آنها به الگوی تقاضای فصلی محصولات بستگی دارد. اخیراً روش “حداکثر تولید اولفین” نیز اهمیت پیدا کرده است که تولید پروپلین، بوتیلنها وLPG به حداکثر میزان خود میرسد. دیاگرام زیر مصرف این محصولات را در تولید Oxigenates (موادی که برای بهسوزی به بنزین اضافه میشوند) را نشان میدهد.
خوراک فرایند FCC میتواند موارد زیر باشد:
- نفت گاز حاصل از تقطیر خلأ(VGO)
- نفت گاز حاصل از تقطیر خلأ که فرایند افزودن هیدروژن نیز روی آن انجام شده باشد.
- مخلوط مواد حاصل از پایین ستون تقطیر (VR) و نفت گاز حاصل از تقطیر خلأ که در این صورت فرایند انجام شده روی آن (Resid FCC) RFCCنامیده میشود.
۴/ شکست تأخیری ( Delayed Coking)
یکی از فرایندهایی است که روی مواد تهمانده حاصل از ستون تقطیر خلأ انجام میشود و نفتهای سبکتر و همچنین ککنفت تولید میکند. نفت سبک میتواند در واحدهای دیگر پالایشگاه به محصولات باارزشتر تبدیل شود. کک حاصله، هم بهعنوان سوخت و هم در ساخت ورقهای آلومینیومی کاربرد دارد.
این فرایند در تبدیل تهماندهها به محصولات سبکتر ۰۷ درصد کارآیی دارد در حالیکه فرایندVisbreaking تنها ۰۳ درصد کارآیی دارد.
۵/ تصفیه هیدروژنی (Hydrotreating)
این فرایند برای تصفیه اجزای تشکیلدهنده نفتخام، در حضور کاتالیستها و مقادیر معتنابهی از هیدروژن بهکار میرود. این فرایند در سولفورزدایی، نیتروژنزدایی و تبدیل اولفینها به پارافینها مؤثر است.
۶/ اصلاح یا تغییر شکلدادن (Reforming)
در این فرایند، هیدروکربنهای خطی به آروماتیکی تغییر شکل میدهند که در بنزین این شکل مناسبتر است. از آنجا که کاتالیست این فرایند، حاوی پلاتین میباشد خوراک آن باید عاری از سولفور باشد.
برای تولید آروماتیکها در صنعت پتروشیمی نیز از این فرایند استفاده میشود.
۷/ شکست حرارتی (Thermal Cracking)
در این فرایند از گرما و فشار برای شکستن مولکولهای سنگین و تولید مولکولهای سبکتر (با خوراک نفت کوره) استفاده میشود. این فرایند شامل Visbreaking، Delayed Coking و فرایندهای مشابه میباشد.
۸/ Vis-breaking
یک فرایند شکست حرارتی ملایم است که از نفتکوره و تهماندههای حاصل از ستون تقطیر اتمسفریک و خلأ، در دمای ملایم، محصولات سبک و با ویسکوزیته پایین تولید میکند و در مناطقی که هنوز نفتکوره سنگین مصرف بالا دارد، رایج است. بهطورکلی باتوجه به مسائل زیستمحیطی، اهمیت آن در سطح جهانی در حال کاهش است.
شیرینسازی (sweetening)
محصولات نفت باید عاری از ترکیبات سولفور (مرکاپتانها) باشند، بهدلیل اینکه در حین سوخت، گازهای نامطلوب Sox تولید میکنند. در فرایند ذکر شده توسط اکسیداسیون، سولفورزدایی انجام میشود که به آن Merox یاMercaptan Oxidation گفته میشود. این فرایند در مورد LPG اشباع و غیراشباع، بنزین و کروزن کاربرد دارد.
جمعبندی:
بهکار گیری فرایندهای تبدیل ثانویه با کارآیی بالا و بالا بودن درجه پیچیدگی پالایشگاه، مزیتهای زیر را درپی دارد:
۱/ انعطافپذیری لازم در فرایند نفتخام با کیفیتهای متنوع از جمله نفتخام نامرغوب، ترش و سنگین
۲/ توانایی تولید درصد بیشتری از محصولات باارزش مثل LPG، فراوردههای تقطیری سبک و میانتقطیر و تولید درصد کمی از محصولات سنگین و نفتکوره که در نتیجه آن ارزشافزوده بالاتری هم حاصل میشود.
۳/ توانایی تولید محصولات (از جمله بنزین و گازوئیل) با کیفیت بالا
باتوجه به آنچه گفته شد تعیین ضریب پیچیدگی پالایشگاههای کشور در ارتقای نوع آنها، همچنین انتخاب خوراک مناسب و نهایتاً سوددهی میتواند مؤثر باشد.
نیکل و تاثیرات آن بر انسان
فلز نیکل
نیکل فلزی سخت ، چکش خوار، براق با ساختار بلورین مکعبی به رنگ سفید- نقره ای است . این عنصر در سال 1751 توسط Axel Cronstedt دانشمند سوئدی کشف گردید . از نظر خواص مغناطیسی وفعالیت شیمیایی شبیه به آهن وکبالت است . کانیهای اصلی نیکل پنتلاندیت ، پیروتیت (سولفید های نیکل- آهن) و گارنییریت (سیلیکات نیکل- منیزیم ) هستند.
نیکل یکی از اجزا اصلی بیشتر شهابسنگها به شمار می آید. شهابسنگهای آهن و سیدریت شامل آلیاژهای آهن حدود 5 تا 20 درصد نیکل می باشد. نیکل تجاری به فرمهای پنتلاندیت و پیروتیت می باشد که این معادن در ایالت انتاریو یافت می شود که این ناحیه حدود 30 درصد از نیکل دنیا را تامین می کند. دیگر معادن این عنصر در کالندونیا، استرالیا، کوبا، اندونزی و در مناطق دیگر یافت می شود. این عنصر رسانای جریان بر ق است و سطح آن براق و صیقلی می باشد. اینعنصر از گروه عناصر آهن و کبالت می باشد و آلیاژهای آن قیمتهای بالایی دارند. این عنصر کاربردهای فراوانی در طبیعت دارد و برای ساخت فولاد ضدزنگ و دیگر آلیاژهای ضد زنگ و خوردگی مثل اینوار و مانل که الیاژى از نیکل و کبالت که در برابر خوردگى مقاوم است و و اینکونل و Hastelloys کاربرد دارد. برای ساخت لوله های نیکلی و مسی و همینطور برای نمک زدایی گیاهان و تبدیل آب شور به آب مایع استفاده می شود. نیکل استفاده های فراوانی برای ساخت سکه ها و فولاد نیکلی برای زره ها و کلید ها کار برد دارد و همینطور از نیکل می توان آلیاژهای نیکروم و پرمالوی و آلیاژی از مس را تهیه کرد. از نیکل برای ساخت شیشه های به رنگ سبز استفاده می شود. صفحات نیکلی می تواند نقش محافظت کننده برای دیگر فلزات را داشته باشد. نیکل همچنین کاتالیزوری برای هیدروژن دار کردن روغنهای گیاهی است. همچنین صنعت سرامیک و ساخت آلیاژی از آهن و نیکل که خاصیت مغناطیسی دارد و باتری های قوی ادیسون کاربرد دارد. از ترکیبات مهم نیکل می توان سولفات و آکسید را نام برد. نیکل طبیعی مخلوطی از 5 ایزوتوپ پایدار است . همچنین 9 ایزوتوپ ناپایدار دیگر نیز شناخته شده است. نیکل هم به صورت فلز و هم به صورت ترکیب محلول می تواند وجود داشته باشد. بخار سولفید نیکل سرطان زا می باشدکه در موقع استفاده از آن باید دقت لازم را به عمل آورد.
نیکل و تاثیرات آن بر انسان نیکل یکی از فراوانترین عناصر است. نیکل در طبیعت معمولا در ترکیب با اکسیژن (اکسیدها) یا گوگرد (سولفیدها) وجود دارد. یکل برای حفظ سلامت حیوانات ضروری است. با اینکه هیچ اثری در نتیجه کمبود نیکل در انسان دیده نشده است ولی احتمالا مقدار کمی از آن برای سلامتی انسان ضروری است ● نیکل:
اثرات نیکل بر سلامت انسان
مقدارنیکل در طبیعت بسیار کم است. انسان در زمینه های مختلف از نیکل استفاده میکند. یکی از عمده ترین کاربردهای نیکل، در صنعت فولاد است. از نیکل به عنوان یکی از اجزا سازنده فولاد و سایر محصولات فلزی استفاده میشود. حتی از نیکل در جواهرات هم استفاده میشود. مواد غذایی به طور طبیعی دارای مقداری نیکل هستند. شکلات و چربی ها دارای مقدار بسیار زیادی نیکل هستند. در صورتیکه افراد از سبزیجات حاصل از مناطق آلوده به نیکل تغذیه کنند، مقدار زیادی نیکل وارد بدنشان میشود. نیکل در بافت گیاهان تجمع می یابد و در نتیجه مقدار نیکل در سبزیجات افزایش پیدا میکند. در ششهای افراد سیگاری مقدار زیادی نیکل وجود دارد. همچنین نیکل در شوینده ها نیز مورد استفاده قرار میگیرد.راههای ورود نیکل به بدن انسان از طریق هوا، آشامیدن آب، خوردن غذا و کشیدن سیگار است. ممکن است بر اثر تماس پوست با خاک یا آب آلوده به نیکل، مقداری نیکل وارد بدن انسان شود. مقدار اندک نیکل برای انسان ضروری است اما اگر مقدار آن افزایش یابد، برای سلامت انسان خطرناک است. نتایج مصرف بالای نیکل به شرح زیر است:شانس مبتلا شدن به سرطان ریه، سرطان بینی، سرطان حنجره و سرطان پروستات را افزایش میدهد. پس از اینکه فرد در معرض گاز نیکل قرار گرفت، دچار کسالت و سرگیجه میشود. آب آوردن ریه ها
مشکلات تنفسی
کاهش توانایی تولید مثل
آسم و برونشیت مزمن
حساسیتهایی از قبیل خارش پوست (به خصوص در هنگام استفاده از جواهرات)نارسایی قلبی
بخارات نیکل به دستگاه تنفس و ریه ها آسیب میرساند. نیکل و ترکیبات آن باعث آماس پوست میشوند که تحت نام " خارش نیکل" نامیده میشود و معمولاً در افراد با حساسیت پوستی بالا مشاهده میشود. اولین علامت، خارش است که معمولاً هفت روز قبل از از بین رفتن پوست رخ میدهد. اولین علائم تخریب پوستی التهاب پوست یا پوسته پوسته شدن پوست است. سپس در پوست زخمهایی نمودار میشود. از لحاظ تقسیم بندی برنامه سمشناسی ملی آمریکا (NTP)، نیکل و ترکیبات آن جزعوامل سرطانزا محسوب میشوند و از نظر طبقه بندی آژانس بین المللی تحقیقات سرطان (IARC) ترکیبات نیکل در گروه یک قرار میگیرند. گروه یک شامل عناصری میباشد که شواهد کافی در مورد سرطانزایی آنها وجود دارد. در این تقسیم بندی عنصر نیکل در گروه 2B قرار دارد. گروه 2B عناصری هستند که ممکن است در انسان سرطان ایجاد کنند.
تاثیرات زیست محیطی نیکل کارخانه ها و سوزاندن زباله ها دو عامل اصلی در تولید نیکل و ورود آن به هوا میباشند. مقدار نیکلی که در هوا وجود دارد به مراتب از نیکل موجود در زمین بیشتر است. مدت زمان از بین رفتن نیکل موجود در هوا زیاد است. زمانیکه هرزآبها جریان پیدا میکنند، مقداری نیکل را وارد آبهای سطحی میکنند. بخش اعظم ترکیبات نیکل در طبیعت جذب ذرات خاک و رسوبات شده و در نهایت به صورت غیر متحرک درمی آیند. در زمینهای اسیدی نیکل بسیار متحرک میشود و معمولاً در آبهایزیرزمینی شسته میشود. شواهد چندانی درباره تاثیر نیکل بر سایر موجودات زنده به غیر از انسان وجود ندارد. در حال حاضر دانشمندان می دانند که غلظت بالای نیکل در خاکهای ماسه ای به گیاهان صدمه میزند و همچنین غلظت بالای نیکل در آبهای سطحی سبب کاهش تعداد و رشد جلبکها میشود. رشد موجودات ذره بینی نیز در حضور نیکل کاهش پیدا میکند، اما معمولاً با گذشت زمان در برابر نیکل مقاوم میشوند. مقدار اندک نیکل باید در غذای جانوران وجود داشته باشد. اما زمانیکه مقدار نیکل از حد مجاز خود فراتر رود، میتواند برای جانوران مضر و خطرناک باشد. جانورانی که در نزدیکی پالایشگاه زندگی میکنند، بر اثر دریافت مقدار زیاد نیکل به انواع مختلف سرطان مبتلا میشوند. از آنجاییکه نیکل در بافتهای گیاهی و جانوری نمیتواند تجمع پیدا کند، اثری در زنجیره غذایی ندارد.
تجهیزات آزمایشگاهی مورد استفاده در تجزیه
اسپکترومتر جرمی ، میکروسکوپ ، کرماتوگرافی مایع و گازی ، اشعه x ، جذب اتمی ، مادون قرمز ، کروماتوگرافی مایع با عملکرد بالا و اسپکترومتر نشری
خواص فیزیکی و شیمیایی عنصر نیکل :
عدد اتمی: 28
جرم اتمی:58.6934
نقطه ذوب: C°1435
نقطه جوش : C°2732
شعاع اتمی : Å 1.62
ظرفیت:2و3
رنگ: سفید – نقره ای
حالت استاندارد: جامد
نام گروه: 10
انرژی یونیزاسیون : Kj/mol 7.635
شکل الکترونی: 2 1s22s2p63s23 p63d 84s
شعاع یونی : Å 0.69
الکترونگاتیوی:1.91
حالت اکسیداسیون:2و3
دانسیته: 8.9
گرمای فروپاشی : Kj/mol 17.47
گرمای تبخیر : Kj/mol 370.4
مقاومت الکتریکی : Ohm m: 0.0000000699
گرمای ویژه: J/g Ko 0.44
دوره تناوبی:4
درجه اشتعال : در حالت جامد اشتعال پذیر
نیکل یکی از فراوانترین عناصر است. نیکل در طبیعت معمولا در ترکیب با اکسیژن (اکسیدها) یا گوگرد (سولفیدها) وجود دارد. این فلز در همه خاکها وجود دارد و از آتشفشانها نیز نشر می شود. نیکل خالص، فلزی سخت و به رنگ سفید-نقره ای است که با دیگر فلزات برای تشکیل آلیاژها ترکیب می شود. تعدادی از فلزات که با نیکل آلیاژ می شوند عبارتند از آهن، مس، کروم و روی .این آلیازها در ساخت سکه های فلزی، جواهرات و اجناس فلزی مورد استفاده قرار می گیرند.ترکبات نیکل همچنین در آبکاری نیکل، سرامیکهای رنگی، بعضی از باطریها و همچنین به عنوان کاتالیزور برای افزایش سرعت واکنشها بکار می روند. نیکل و ترکیباتش بو مزه خاصی ندارند.نیکل برای حفظ سلامت حیوانات ضروری است. با اینکه هیچ اثری در نتیجه کمبود نیکل در انسان دیده نشده است ولی احتمالا مقدار کمی از آن برای سلامتی انسان ضروری است. در محیط، نیکل بیشتر در خاک و رسوبات وجود دارد زیرا نیکل با ذراتی که حاوی آهن یا منگنز هستند و در خاکها و رسوبات موجود هستند، اتصال برقرار می کند.آژانس حفاظت از محیط زیست (EPA)، حداکثر مقدار مجاز نیکل در آب آشامیدنی کودکان را ۰۴/۰ میلی گرم در لیتر تعیین کرده است. میزان مجاز نیکل در هوای محل کارهای مرتبط، یک میلی گرم در مترمکعب برآورد شده است. در حال حاضر مقدا نیکل موجود در محیطهای کار، بسیار کمتر از گذشته است و به همین دلیل علائم آلودگی با نیکل در کارگران کمتر دیده می شود.منابع اصلی آلودگی با نیکل استعمال تنباکو، اگزوز خودرها، کودهای شیمیایی، سوپر فسفاتها، فرآورده های غذایی، روغنهای هیدروژنه، فاضلابهای صنعتی، صنایع فولاد زنگ نزن، آزمایش تجهیزات هسته ای، بکینگ پودر و ... می باشند. تنفس هوا یا دود تنباکوی محتوی نیکل و یا خوردن مواد غذایی و آب حاوی نیکل و تماس با سکه ها و فلزات حاوی نیکل، منابع اصلی آلودگی انسان با نیکل هستند.● تاثیرات نیکل بر انسان:
متداولترین اثر نیکل بر انسان یک واکنش آلرژیک است. انسان می تواند در صورت آلودگی با منابع ذکر شده در بالا دچار حساسیت شود. اشخاصی که به نیکل حساس هستند، در صورت تماس زیاد با آن دچار یک واکنش می شوند و معمولترین واکنش، تحریک آن قسمت از پوست است که با نیکل تماس پیدا کرده است. در برخی موارد ممکن است فرد حساس، در صورت آلودگی با نیکل دچار تنگی نفس می شوند. در کارگرانی که مقادیر بالایی از نیکل را تنفس کرده بودند مشکلات ریوی، شامل برونشیت مزمن و کاهش توان ریه ها مشاهده گردید.مسمومیت حاد با استنشاق نیکل کربونیل اتفاق می افتد. این اثرات حاد در طی دو مرحله ظاهر می شوند، مرحله اول اثرات فوری و مرحله دوم با اثرات با تاخیر. سردرد، سرگیجه، تنفس بریده بریده، تهوع و استفراغ علائم اولیهء آلودگی شدید است. اثرات تاخیری (۱۰ تا ۳۶ ساعت بعد) ظاهر می شوند و شاملِ درد سینه، سرفه، تنفس بریده بریده، بی رنگی و مایل به آبی شدن پوست و در موارد بسیار حاد, هذیان گویی، تشنج و مرگ می باشد. بهبودی این مسمومیت، طولانی خواهد بود. کارگرانی که بطور تصادفی آب آشامیدنی را که حاوی ۱۰۰٫۰۰۰ برابر حد مجاز نیکل را مصرف کردند، دچار شکم درد، مشکلات کلیوی و خونی شدند.آلودگی طولانی مدت و مداوم با نیکل کربونیل با افزایش شیوع سرطان ریه و سینوس ها همراه است . محصولات حاصل از تجزیهء نیکل (نیکل اکسید و کربن مونوکسید)، نسبت به خود نیکل کربونیل سمیت کمتری دارند. در موشهایی که برای مدتی ترکیبات نیکل را استنشاق کرده بودند، ترکیباتی از نیکل که به سختی در آب حل می شوند، موجب سرطان شدند و ترکیباتی که در آب حل می شدند، موردی را ایجاد نکردند.بخش سلامت و سرویسهای انسانی (DHHS)، نیکل و ترکیبات خاصی از آن را بعنوان عوامل سرطانزای احتمالی معرفی کرده اند. در کارگران پالایشگاهها و کارخانجات آبکاری که غلظتهای بالایی از ترکیبات نیکل را استنشاق کرده بودند، سرطان ریه و سینوسهای بینی مشاهده شده بود. IARC ، نیکل و ترکیباتش را در گروه ۲B (عوامل سرطانزای احتمالی) طبقه بندی کرده اند.
تولید بنزین و فرآورده های میان تقطیر از مایعات گازی
لطفا به این لینک مراجعه فرمایید
طبقه بندی مواد شیمیایی
ماده ، به هر چیزی که حجمی را اشغال کند و جرمی داشته باشد، اطلاق میشود. مواد شیمیایی به موادی اطلاق میگردد که معمولا از طریق سنتز شیمیایی تهیه میشوند و یا اینکه منشأ طبیعی داشته و مواد اولیه تهیه سایر مواد شیمیایی به حساب میآیند.
طبقه بندی مواد شیمیایی
مواد شیمیایی بطور عمده به دو گروه بزرگ مواد معدنی و مواد آلی تقسیم بندی میشوند. هر یک از این دو گروه ، در دو مبحث شیمی آلی و شیمی معدنی بررسی میشوند. در این مطالعه ، خواص فیزیکی و شیمیایی مواد آلی و معدنی ، منابع ، طریقه سنتز و واکنشها و ... مورد بررسی قرار میگیرند.
مواد شیمیایی آلی
در قدیم ، ماده آلی به مادهای اطلاق میگردید که بوسیله بدن موجودات زنده ساخته میشد. تا اینکه در سال 1828 ، "وهلر" (Wohler) دانشمند آلمانی ، برای اولین بار جسمی به نام اوره به فرمول CO(NH2)2 را در آزمایشگاه از یک ترکیب معدنی به نام ایزوسیانات تهیه نمود و از آن پس معلوم شد که میتوان مواد آلی را نیز در آزمایشگاه ساخت.
امروزه بیش از یک میلیون نوع ماده آلی شناخته شده است که بسیاری از آنها را در آزمایشگاهها تهیه میکنند. مواد آلی ، به مواد غیر معدنی گفته میشود و با مواد معدنی تفاوتهای کلی در چند مورد دارند.
مواد شیمیایی معدنی
اگر شیمی آلی به عنوان شیمی ترکیبات کربن ، عمدتا آنهایی که شامل هیدروژن یا هالوژنها به علاوه عناصر دیگر هستند، تعریف شود، شیمی معدنی را میتوان بطور کلی به عنوان شیمی عناصر دیگر در نظر گرفت که شامل همه عناصر باقیمانده در جدول تناوبی و همینطور کربن ، که نقش عمدهای در بیشتر ترکیبات معدنی دارد، میگردد.
شیمی آلی - فلزی ، زمینه وسیعی که با سرعت زیاد رشد میکند، به علت اینکه ترکیبات شامل پیوندهای مستقیم فلز - کربن را بررسی میکند دو شاخه را بهم مرتبط میسازد. همانطوری که میتوان حدس زد، قلمرو شیمی معدنی با فراهم کردن زمینههای تحقیقی اساسا نامحدود ، بسیار گسترده است.
مقایسه مواد آلی و مواد معدنی
مواد شیمیایی آلی و معدنی با همدیگر تفاوتهای کلی دارند که عبارتند از:
- در تمام مواد آلی حتما کربن وجود دارد، در صورتی که مواد معدنی بدون کربن بسیارند. ضمنا در ترکیبات آلی ، اتمهای کربن میتوانند با یکدیگر ترکیب شوند و زنجیرهای طویل تشکیل دهند، در حالیکه این خاصیت در عناصر دیگر خیلی کمتر دیده میشود.
- مقاومت مواد آلی در برابر حرارت از مواد معدنی کمتر است.
- اغلب واکنشهای میان مواد آلی کند و دو جانبه یا تعادلی هستند، در صورتیکه اغلب واکنشهای معدنی تند میباشند.
- در ترکیبات آلی ، ممکن است 2 یا چند جسم مختلف با فرمولهای ساختمانی مختلف ، دارای یک فرمول مولکولی باشند که در این صورت به آنها ایزومر یا همفرمول گفته میشود. مثلا الکل معمولی C2H5OH با جسمی به نام اتر اکسید متیل CH3OCH3 همفرمول یا ایزومر است. زیرا هر دو دارای فرمول بسته یا مولکولی C2H6O هستند، در صورتی که پدیده ایزومری در ترکیبات معدنی وجود ندارد.
تقسیم بندی مواد شیمیایی آلی
عناصر تشکیل دهنده ترکیبات شیمیایی آلی به ترتیب فراوانی مطابق زیر است:
فلزات , هالوژنها , C , H , O , N , S , P , As . فراوانترین چهار عنصر N , O , H , C عناصر اصلی سازنده مواد آلی به حساب میآیند. زیرا اغلب اجسام آلی از این چهار عنصر تشکیل یافتهاند و با توجه به همین مطلب ، مواد آلی را به چهار دسته کلی تقسیم میکنیم:
هیدروکربنهای ساده
ترکیباتی هستند که فقط از H , C درست شدهاند و به همین دلیل ، هیدروکربن شدهاند. آنها با فرمول کلی CxHy نمایش میدهند. بسته به اینکه y , x چه اعدادی باشند، هیدروکربنهای گوناگون یافت میشوند.
هیدروکربنهای اکسیژندار
ترکیباتی هستند که از O , H , C درست شده اند و با فرمول کلی CxHyOz نشان داده میشوند.
هیدروکربنهای نیتروژندار
ترکیباتی هستند که از N , H , C درست شدهاند و با فرمول کلی CxHyNt نشان داده میشوند.
هیدروکربنهای اکسیژن و نیتروژن دار
ترکیباتی هستند که علاوه بر H ، C ، اکسیژن و نیتروژن و با فرمول کلی CxHyOzNt نمایش داده میشوند.
بنزین
یکی از مشتقات نفت میباشد که در پالایشگاه نفت تولید میگردد و برای سوخت خودروهای سبک مورد استفاده قرار میگیرد.
بنزین که در انگلیسی با نام های گازولین " و پترول شناخته می شود مایعی مشتق شده از نفت می باشد که عمدتا شامل هیدروکربن ها است. همچنین حاوی بنزن می باشد ؛ و به عنوان سوخت در موتور سوخت داخلی مورد استفاده قرار می گیرد.
اکثر کشورهای مشترک المنافع به استثنای کانادا از عبارت "پترول " (مخفف جوهر نمک ) استفاده می کنند. عبارت گازولین عمدتا در آمریکای شمالی به کار می رود که معمولا در کاربردهای محاوره ای گاز گفته می شودکه باید بتوان در زمینه کاربرد آن را از سوختهای گازی مورد استفاده در موتورهای سوخت داخلی از قبیل گاز نفت مایع کاملا متمایز کرده عبارت mogas مخفف “Motor gasoline” بوده و از سوخت اتومبیل و بنزین هواپیما یا avgas متمایز است. کلمه بنزین همچنین در انگلیسی برتانیایی استفاده می شود که به یک مشتق متفاوت نفت که در چراغ به کار می رود اشاره دارد. به هر حال این مورد استفاده امروزه رایج نیست. در لجهه اکثر اسپانیولی های آمریکایی الاصل کلمه gasoline وجود دارد که از آمریکای شمالی گرفته اند.
تجزیه شیمیایی :
بنزین در پالایشگاه های نفت تولید می شود. ماده ای که توسط تقطیر از نفت خام جدا می شود بنزین طبیعی نام دارد که ویژگی های مورد نیاز را برای موتورهای پیشرفته ( به طور خاص نرخ اکتان پایین را ببینید.) نداشته اما بخشی از مخلوط را تشکیل خواهد داد. توده بنزین شامل هیدروکربن های دارای 5 تا 7 عدد اتم کربن در هر مولکول می باشد.
بسیاری از این هیدروکربن ها مواد خطرناکی بوده و قوانین مرتبط با آنها توسط “OSHA” وضع می شوند. MSDS برای بنزین بدون سرب حداقل پانزده ماده شیمیای خطرناک را نشان می دهد که در مقادیر حجمی مختلف بنزین از 5 تا 35 درصد وجود دارد. این مواد شامل بنزین بالاتر از 5درصد حجمی ، تولوئن بالاتر از 35درصد حجمی ، نفتالن بالاتر از 1درصد حجمی 1 و 2و 4- تری متیل بنزن بالاتر از 7درصد حجمی ، MTBE بالاتر از 18 درصد حجمی و حدود 10 ماده دیگر می باشد. (رجوع کنید به[5])
فرآورده پالایشگاه های مختلف با هم آمیخته و بنزین را با خواص مختلف می سازد بعضی ازفرایندهای مهم عبارتند از :
- رفرمات که در اصلاح کننده کاتالیزوری با عدد اکتان بالا شامل مقدار زیادی ماده آروماتیک و مقدار بسیار کم آلکن ها است.
- بنزینی که توسط کاتالیزور شکسته شده که همچنین گازولین ویا مولکول نفتا نامیده می شود از فرایند تجزیه کاتالیزوری با عدد اکتان مناسب محتوای آلکن اولفین های بالا و سطح بالای ماده آروماتیک تهیه می شود. * هیدرورکراکت سنگین متوسط و سبک از هیدروکراکر با عدد اکتان متوسط تا پایین و سطح ماده آروماتیک مناسب تهیه می شود.
- بنزین طبیعی (که دارای نام های زیادی است ) مستقیما از نفت خام با عدد اکتان پایین ماده آروماتیک پایین ( به نفت خام بستگی دارد ) مقداری از نفتن ها سیکلو آلکان ها و اولفین ها ی صفر آلکن ها
- آلکیلات تولید شده در واحد آلکیلاسیون دارای عدد اکتان بالا بوده و آلکان پارافین خالص است عموما دارای زنجیره های شاخه دار است. * ایزومرات (با نام های مختلف) که جهت افزایش عدد اکتان خود از بنزین طبیعی ساخته می شود و مقدار کمی مواد آروماتیک دارد.
( عبارات به کار رفته در اینجا همیشه عبارات شیمیایی صحیح نیستند. اینها نوعا" از قدیم مرسوم بوده اما عبارات معمول مورد استفاده در صنعت نفت هستند.اصطلاحات دقیق این محصولات بسته به نوع شرکت نفت و کشور مورد نظر متفاوت است.)
به طور کلی بنزین معمولی عمدتا مخلوطی از پارافین ها آلکان ها ، نفتن ها سیکلو آلکان ها آروماتیک ها و اولفین ها آلکن ها .نسبت های دقیق به عوامل زیر بستگی دارد :
- پالایشگاه نفت که سازنده بنزین است از این نظر که پالایشگاه ها یکسری واحدهای پردازش مشابه دارند.
- نفت خام مورد استفاده پالایشگاه در یک روز خاص.
- درجه بنزین و به طور خاص عدد اکتان آن.
امروزه بسیاری از کشورها در موردترکیبات آروماتیک بنزین به طور عام بنزن به طور خاص و ترکیب اولفین آلکن محدودیت هایی را اعمال می کنند. تقاضای اجزای تشکیل دهنده پارافین آلکان خالص با عدد اکتان بالا از قبیل آلکیلات در حال افزایش است و پالایشگاه ها مجبور به افزودن واحدهای پردازش جهت کاهش محتوای بنزن هستند.
بنزین همچنین شامل مواد آلی دیگری نیز می باشد ؛ از قبیل اترهای آلی (که با هدف به آن افزوده شده ) به اضافه مقدار کمی ناخالصی ، اختصاصا ترکیبات گوگرد از قبیل دی سولفیدها و تیوفن ها بعضی از ناخالصی ها برای مثال تیول ها و سولفید هیدروژن به علت ایجاد خوردگی در موتورها باید حذف شوند.
فراریت:
بنزین از نفت دیزل جت – A یا کروسن نه تنها به خاطر اجزای تشکیل دهنده اصلی بلکه به دلیل افزاینده ها که به آن افزوده می شود بیشتر است. فراریت مطلوب بستگی به دمای محیط دارد : در هوای گرم تر اجزایی از بنزین مورد استفاده قرار می گیرند که وزن مولکولی بالاتر وبنابراین فراریت کمتر دارند. در هوای سرد برای اینکه ماشین شروع به کار کند از اجزای با فراریت بسیار کم استفاده می شود. در هوای گرم فراریت اضافی باعث اشباع شدن بخار می شود که در این حالت احتراق رخ نمی دهد. در استرالیا محدوده فراریت هر ماه تغییر می کند وبرای هر مرکز توزیع اصلی تفاوت دارد. اما اکثر کشورها به سادگی محدوده تابستانی زمستانی و حتی چیزی بین این دو را دارند در ایالات متحده برای کاهش نشر هیدروکربن هایب سوخته نشده مراکز شهری بزرگی تاسیس می شود. در شهرهای بزرگ از بین دیگر خواص بنزین بنزین با فرمولاسیون جدید که کمتر تبخیر می شود مورد نیاز است.
استانداردهای فراریت در موارد اضطراری که کمبود بنزین وجود دارد کمتر رعایت می شوند ( و درنتیجه عناصر آلاینده بنزین در جو زمین افزایش می یابد). برای مثال در تاریخ 31آگوست 2005 ایالات متحده در پاسخ به هاریکن کاترینا مجوز فروش بنزین بافرمولاسیون قبلی را در بعضی از نواحی شهری صادر کرد که باعث شد که استفاده از بنزین زمستانی زودتر از حدمعمول انجام شود. طبق دستور ریاست EPA استفان جانسون این نادیده انگاری استانداردهای سوخت از تاریخ 15 سپتامبر 2005 اجرا شد. [6] اگر چه استاندارهای کاهش یافته فراریت باعث تخریب لایه اوزون و آلودگی هوا می شوند بنزین دارای فراریت بالاتر (که در مقایسه با بنزین با فراریت پایین افزاینده های کمتری دارد) ذخیره بنزین کشور را به طور محسوس افزایش می دهد چرا که پالایشگاه های نفت می توانند با سهولت بیشتر محصول خود را تولید کنند.
عدد اکتان:
مهمترین خاصیت بنزین عدد کتان آن است که نشان دهنده میزان مقاومت بنزین در برابر افنجار زودهنگام در کاربراتور موتور است که باعث ضربه زدن به موتور می شود. این عدد نسبت به مخلوط 2 و 2 و 4- تری متیل پنتان لیزومر اکتان و n - هپتان اندازه گیری می شود. معیارهای قراردادی مختلفی برای بیان عدد اکتان وجود دارد بنابراین بسته به سیستم مورد استفاده سوخت های مشابه ممکن است اعداد اکتان متفاوت داشته باشند.
سلامت:
بسیاری از هیدروکربن های غیر آلیفاتیک که به طور طبیعی در بنزین موجودند (مخصوصا هیدروکربن های آروماتیک مانند بنزن ) مشابه بسیاری از افزاینده های ضد ضربه سرطان زا هستند. به این دلیل هرگونه نشت بنزین در مقیاس بزرگ که باعث تهدید سلامت عموم و محیط شود. خطرات اصلی این نشت ها ناشی از وسایل نقلیه نیست بلکه از تصادف کامیون های حامل بنزین می باشد که طی این رخداد بنزین از تانکرهای ذخیره نشت می شود. به دلیل وجود این خطر امروزه بر روی محل نصب اکثر تانکر های ذخیره ( زیرزمینی ) محاسبات گسترده ای انجام می گیرد تا هرگونه نشت مشخص شده و از آن جلوگیری شود. با توجه به اینکه بنزین نسبتا فرار ( بدین معنی که زود تبخیر می شود ) است باید آنها را در تانکرهایی ذخیره کرد و در صورت حمل و نقل با وسایل نقلیه آنها را کاملا مهرو موم نمود. فراریت بالای بنزین همچنین به این معناست که برخلاف سوخت دیزل که در شرایط هوایی سرد به آسانی آتش می گیرد یک سیستم تهویه مناسب برای اطمینان از اینکه سطح فشار در داخل و بیرون یکسان است مورد نیاز می باشد. بنزین به طور خطرناک با مواد شیمیایی معمول و خاصی وارد واکنش می شود. برای مثال بنزین بلور Drano و هیدروکسید سدیم طی یک احتراق خود به خود یا هم واکنش می دهند.
بنزین همچنین یکی از منابع گازهای آلاینده است. حتی بنزینی که دارای سرب یا گوگرد یا دیگر ترکیبات شیمیایی نباشد اگزوز موتور ای که در حال حرکت است تولید دی اکسید کربن , اکسیدهای نیتروژن و مونوکسید کربن می کند. علاوه بر این بنزین نسوخته طی تبخیر از تانک در جو با نور خورشید واکنش داده و تولید مه دود فتوشیمیایی می کند. افزودن اتانول فراریت بنزین را افزایش می دهد.
در صورت استفاده ناصحیح از بنزین به عنوان ماده ای که قابل استنشاق است بنزین سلامت رابه خطر می اندازد. برای بسیاری از مردم استنشاق بنزین معمول ترین راه رسیدن به حالت مستی است و در بسیاری از جوامع فقیرتر از قبیل بومی های استرالیا به صورت همه گیر اپیدمی در آمده است. اپال توسط پالایشگاه کوینانا BP در استرالیا توسعه یافته و تنها شامل 5درصد ترکیبات آروماتیک ( برخلاف حد معمولش که 25درصد است) می باشد که در نتیجه استنشاق آن اثرات زیان بارکمتری متوجه فرد است.
- بیودیزل، برای موتورهای دیزلی
- بیواتانول، برای متورهای بنزینی
- موتورهای هیبرید، که باعث صرفه جویی در مصرف سوخت می شوند.
- منبع : ویکی پدیا
تعیین دمای ذوب
تعیین دمای ذوب:
دمای ذوب را عمدتا به دو طریق زیر تعیین میکنند:
1-لوله تیل
2-دستگاههای اندازه گیری دقیق میکروسکوپی
1- لوله تیل:
وسیله ساده ای است که به سهولت قابل دسترسی است.
لوله تیل به نحوی طراحی شده است که وقتی در آن روغن می ریزیم و لوله را گرم می کنیم، در آن تبادل گرمایی صورت می گیرد.
به نحوی که توزیع دما در سراسر روغن داخل لوله یکنواخت می شود. چنانچه لوله تیل در دسترس نباشد از یک بشر کوچک 50 یا 100 میلی لیتری می توان به عنوان حمام استفاده کرد.
آماده کردن نمونه:
مقدار کمی از ترکیب جامد را در هاون بسایید و به صورت پودر نرمی در آورید. یک لوله مویین به طول حدود 10 سانتیمتر بردارید و یک انتهای آن را با استفاده از شعله مسدود کنید. انتهای باز لوله را در توده نرم شده فرو کنید تا مقداری از آن داخل لوله شود. سپس ته لوله را چند بار آهسته روی میز بزنید تا تمام پودر در انتهای آن قرار گیرد. همچنین می توانید یک لوله شیشه ای را که ابتدا و انتهای آن باز است به طور عمودی روی میز قرار دهید و لوله مویین را از سمت انتهای بسته در آن رها کنید. لوله مویین را به کمک یک نخ یا کش به دماسنج متصل کنید به طوری که انتهای لوله مویین و بخش جیوه ای دماسنج هم تراز شوند. اکنون دماسنج و لوله مویین را به کمک پایه و گیره در داخل حمام روغن قرار دهید. حمام را به آهستگی با شعله (چراغ بنسن) گرم کنید و دمای ابتدا و انتهای ذوب شدن را از روی درجات دماسنج با دقت بخوانید و یادداشت کنید. اگر دمای ذوب یک ترکیب شناخته شده نیست معمولا دو لوله مویین حاوی ترکیب آماده می کنند. با لوله مویین اول نقطه ذوب را سریعا اندازه می گیرند. سپس دمای حمام را تا حدود 30 درجه کاهش می دهند و با استفاده از لوله مویین دوم نقطه ذوب را به آرامی و با دقت تعیین می کنند. اگر لوله مویین در دسترس نباشد با استفاده از یک لوله شیشه ای به قطر حدود 0.5 سانتی متر و طول 25 سانتی متر لوله مویین بسازید.
نقاط ذوب مخلوط ها:
دمای ذوب هر ماده بلوری خالص، یک خاصیت فیزیکی آن ماده است و می توان از آن برای شناسایی یک ترکیب استفاده کرد. به طور کلی افزایش تدریجی و پی در پی ناخالصی به یک ماده خالص سبب می شود که به نسبت مقدار ناخالصی افزوده شده نقطه ذوب کاهش یابد.
دمای تقطیر و جوش:
فشار بخار مایعات، براثر گرم شدن آنها زیاد می شود تا حدی که فشار بخار مایع برابر فشار هوا می شود. در این حالت جوشیدن مایع قابل رویت است. این دما را نقطه جوش یا دمای جوش می نامند. با کاهش فشار، نقطه جوش نیز پایین می آید زیرا انرژی گرمایی کمتری برای برقراری تعادل بین فشار بخار مایع و فشار هوا (که کم شده است) لازم است. نقطه جوش در فشار یک اتمسفر را نقطه جوش عادی (نرمال) می گویند. فرایند تبخیر و سپس میعان مجدد یک مایع را تقطیر می گویند. این روش برای جدا کردن مخلوط چند جزء که نقاط جوش متفاوتی دارند سودمند است. همچنین یک روش اساسی برای تخلیص مایعات به شمار می آید. نقطه جوش مایع خالصی که در طول عمل تقطیر تجزیه نمی شود، دقیق و در تمام مدت جوش ثابت است. تعیین نقطه جوش (bp) با دو روش به آسانی امکان پذیر است. استفاده از این دو روش به مقدار ماده موجود بستگی دارد.
۱. چنانچه مایع به مقدار کافی یا زیاد در دسترس باشد، نقطه جوش آن را می توان به روش تقطیر ساده و به کمک دماسنج تعیین کرد.
۲. در صورتی که مقدار مایع کم باشد، از روش نقطه جوش میکرو استفاده می شود.
تعیین نقطه جوش به روش میکرو:
در این روش از لوله آزمایشی به قطر داخلی 5 میلی متر و طول تقریبی 12 سانتیمتر استفاده می شود. مقداری از مایع مورد نظر (0.2 تا 0.5 میلی لیتر) را به وسیله پی پت یا قطره چکان به درون لول آزمایش می ریزیم. سپس لوله مویینی را که یک انتهای آن مسدود شده است به طور واژگون از انتهای باز آن به درون لوله می اندازیم. بعد این لوله را به وسیله نخ یا نوار لاستیکی به دماسنج می بندیم. همانگونه که در تعیین نقطه ذوب عمل کردیم. انتهای لوله و دماسنج باید در یک سطح باشند. این مجموعه را در حمام روغن قرار می دهیم و به آرامی گرم می کنیم. پس از مدتی گرم کردن، جریان منظم و یکنواختی از حباب هوا از انتهای لوله مویین خارج می شود. در این مرحله گرما را قطع می کنیم و ملاحظه می شود که جریان حباب هوا قطع می شود و سپس مقداری از مایع وارد لوله مویین می شود. در این لحظه عدد دماسنج را می خوانیم و ثبت می کنیم. این دما، نقطه جوش مایع است. در تعیین نقطه جوش به روش میکرو مشکلاتی به شرح زیر پیش می آید:
*چون مقدار مایع اندک است، در صورت افزایش ناگهانی گرما احتمال بخار شدن آن وجود دارد، و یا اینکه ممکن است نقطه جوش به دست آمده بیشتر از مقدار واقعی باشد.
* اگر گرم کردن کافی نباشد، در نزدیکی نقطه جوش، در صورت گرما، ممکن است مایع از لوله آزمایش، وارد لوله مویین شود، زیرا در این لحظه فشار بخار مایع پایینتر از فشار هواست. نقطه جوش به دست آمده در این روش به علت تجربه ناکافی آزمایش کننده و خطای چشم، تقریبی، و غالبا کمتر از مقدار واقعی است.
با تشکر از دوست عزیزم جناب آقای فراهانی
کاتالیزور
کاتالیزور ماده ای است که سرعت یک واکنش شیمیایی را افزایش می دهد بدون آنکه خود در جریان واکنش مصرف شود.
ریشه لغوی
کاتالیزور از دو صفت کاتا و لیزور تشکیل شده است. در زبان یونانی "کاتا" به معنای پائین ، افتادن ، یا پائین افتادن است و "لیزور" به معنی قطعه قطعه کردن میباشد. در برخی زبانها کاتالیزور را به معنی گردهم آوردن اجسام دور از هم معرفی کرده اند.
تاریخچه
اولین گزارش استفاده از کاتالیزور ، مربوط به کریشف میباشد که با استفاده از یک اسید به عنوان کاتالیزور توانست نشاسته را به قند ، هیدرولیزکند. بعدها دیوی توانست واکنش اکسیداسیون هیدروژن را با اکسیژن در حضور کاتالیزورپلاتین انجام دهد که این واکنش یک واکنش گرما گیر است و در نتیجه هنگام انجام واکنش جرقه تولید میشد.
اولین کار در توضیح اینکه چرا یک واکنش کاتالیزوری انجام میگیرد و کاتالیزور چه نقشی دارد، توسط "فارادی" انجام شد. بیشترین بهرهبرداری از کاتالیزور در جنگ جهانی بود.
انقلاب تکنولوژی اصلی در زمینه کاتالیزور مربوط به نیمه دوم قرن 20 یعنی بین سالهای1980 ـ 1950 میباشد.دهه 1960 ـ 1950 دهه ای است که با تولید کاتالیزورهای زیگر _ ناتا ترکیبات بسیار مهم و استراتژیک ساخته شد.
انواع کاتالیزور
کاتالیزور به دو نوع کاتالیزور مرغوب و نامرغوب تقسیم میشود:
- کاتالیزور مرغوب: کاتالیزور مرغوب به کاتالیزوری گفته میشود که فقط اجازه تشکیل یک نوع محصول را بدهد.
- کاتالیزور نامرغوب: اگر در حضور کاتالیزور محصولات متفاوتی امکان تشکیل داشته باشند کاتالیزور نامرغوب تلقی میشود.
چگونگی عمل کاتالیزور
تجربه نشان داده است که واکنش با کاتالیزور در دمای کمتری صورت میگیرد و همچنین کاتالیزور ، انرژی اکتیواسیون را پائین میآورد یا کاهش میدهد یا باعث میشود مولکولهای درشت به مولکولهای کوچکتر ، قطعهقطعه یا شکسته شوند.
کاتالیزور واکنش را میتوان بدون تغییر در پایان واکنش بدست آورد. مثلا سرعت تجزیه KClO3 را با مقدار کمی MNO2 میتوان فوقالعاده زیاد کرد. در معادلهای که برای این تغییر نوشته میشود ، کاتالیزور را بالای پیکان میگذارند ، زیرا کاربرد آن در استوکیومتری کل واکنش اثری ندارد:
مکانیسم واکنش کاتالیزوردار
کاتالیزور نمیتواند موجب وقوع واکنشهایی شود که از نظر ترمودینامیک امکان وقوع ندارند. بعلاوه صرفا حضور کاتالیزور نیست که (احتمالا بعنوان یک بخش فعالکننده) موجب اثر بر سرعت واکنش میشود. در یک واکنش کاتالیزوردار ، کاتالیزور در یک مرحله عملا مصرف میشود و در مرحله بعدی بار دیگر تولید میگردد و این عمل بارها تکرار میگردد، بدون آنکه کاتالیزور دچار تغییر دائمی شود.
بنابراین کار کاتالیزور آن است که راه تازه ای برای پیشرفت واکنش میگشاید. بدین ترتیب مکانیسم کاتالیزوردار با یک واکنش بیکاتالیزور تفاوت دارد. انرژی فعال سازی راهی که واکنش به کمک کاتالیزور طی میکند، کمتر از انرژی فعالسازی راهی است که همان واکنش بدون کاتالیزور میپیماید (شکل 1) 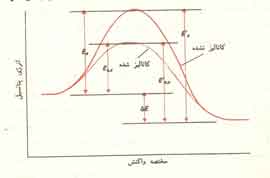
این واقعیتی است که علت سریعتر شدن واکنش را توجیه میکند. وقتی کاتالیزور بکار برده میشود، مولکولهای نسبتا بیشتری انرژی لازم برای یک برخورد موفق پیدا میکنند (شکل 2). بدین ترتیب عده کل برخوردهای موثر در واحد زمان، که موجب انجام واکنش میشوند، افزایش مییابد.
در شکل 1 به دو نکته دیگر نیز پی میبریم. نخست آنکه تغییرات انرژی برای واکنش کاتالیزوردار و واکنش بیکاتالیزور یکسان است. دیگر آنکه انرژی فعال سازی واکنش معکوس نیز به هنگام استفاده از کاتالیزور کاهش مییابد و مقدار کاهش آن درست برابر کم شدن انرژی فعال سازی واکنش کاتالیزوردار اصلی است. این بدان معنی است که کاتالیزور بر یک واکنشی و واکنش معکوس آن اثر یکسان دارد. اگر یک کاتالیزور سرعت یک واکنش را دو برابر کند، همان کاتالیزور سرعت واکنش معکوس آن را نیز دو برابر خواهد کرد.
کاتالیزورهای طبیعی (آنزیم)
بسیاری از فرایندهای صنعتی به اعمالی بستگی دارند که با کاتالیزور صورت میگیرند. ولی کاتالیزورهایی که برای انسان مورد اهمیت بیشتری دارند، کاتالیزورهای طبیعی یعنی آنزیمها هستند. این مواد فوق العاده پیچیده ، فرایندهای حیاتی مانند گوارش و سنتز سلولی را کاتالیز میکنند.
عده زیادی از واکنشهای شیمیایی پیچیده که در بدن صورت میگیرد و برای حیات ما ضرورت دارد، به علت اثر آنزیمها در دمای پائین بدن امکان وقوع پیدا میکنند. هزاران آنزیم وجود دارند که هر یک وظیفه خاصی را انجام میدهند. تحقیق درباره ساختمان و عمل آنزیمها ، نویدهای فراوانی درباره پیشرفت شناخت عامل بیماری و مکانیسم رشد میدهد. 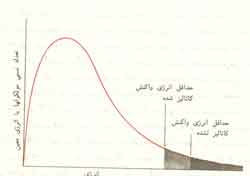
کاتالیزور همگن و ناهمگن
در کاتالیزور همگنماده ای که بعنوان کاتالیزور کار میکند، با مواد واکنشدهنده در یک فازند، ولی در یک کاتالیزور ناهمگن یا کاتالیزور سطحی ، مواد واکنشدهنده و کاتالیزور در دو فاز مجزا کنار هم هستند و واکنش در سطح کاتالیزور صورت میگیرد.
کاتالیزور همگن
نمونه ای از کاتالیزور همگن در فاز گازی ، اثر کلر در تجزیه دینیترون اکسید است. گاز دینیترون اکسید ، در دمای اتاق ، گاز نسبتا بیاثری است، اما در دماهای نزدیک به صد درجه طبق معادله زیر تجزیه می شود.
مطالعات سینتیک نشان میدهد که واکنش مذکور بر اثر برخورد بین دو ملکول کلر کاتالیز میشود.
کاتالیزور همگن در محلول نیز ممکن است صورت گیرد. بسیاری از واکنشها بوسیله اسیدها و بازها کاتالیز میشوند. تجزیه هیدروژن پراکسید در حضور پون یدید کاتالیز میشود.
کاتالیزور ناهمگن
کاتالیزور ناهمگن عمدتا از طریق جذب سطحی شیمیایی مواد واکنش دهنده بر سطح کاتالیزور صورت میگیرد. جذب سطحی فرآیندی است که در جریان آن مولکولها به سطح جسمی جامد میچسبند. مثلا در ماسکهای گازی ، زغال به عنوان یک ماده جاذب برای گازهای زیان آور بکار میرود.
در جذب سطحی فیزیکی معمولی ، مولکولها ، بوسیله نیروهای و اندروالسی به سطح ماده جاذب ، گیر میکنند. بنابراین مولکولهایی از گاز که جذب سطحی شدهاند، تا همان حد تحت تاثیر قرار گرفتهاند که گویی مایع شده باشند.
در جذب سطحی شیمیایی ، مولکولهای جذب شده ، با پیوندهایی که قابل مقایسه با پیوندهای شیمیایی است، به سطح ماده کاتالیزور نگه داشته میشوند. در فرایند تشکیل پیوند با ماده جاذب ، مولکولهایی که بطور شیمیایی جذب شدهاند، دچار تغییر آرایش الکترونی درونی میشوند. پیوندهای درون بعضی از مولکولهای کشیده و ضعیف و حتی پیوند بعضی از آنها شکسته میشوند.
مثلا هیدروژن بصورت اتمی بر سطح پلاتین جذب میشود. بنابراین تعدادی از ملکولها که بطور شیمیایی جذب سطحی شدهاند، به صورت کمپلکس فعال شده یک واکنشی که در سطح کاتالیزور شده، عمل میکند.
مکانیسم جذب سطحی شیمیایی:
تاکنون مکانیسم دقیق جذب سطحی شیمیایی و کاتالیز سطح کاملا فهمیده نشده است، فقط فرضهایی قابل قبول برای مکانیسم چند واکنش خاصی مطرح شده است:
- نظری دال بر اینکه نقصها یا بینظمیهای شبکه در سطح کاتالیزور ، جای فعالی برای عمل کاتالیزور است، اولین فرضیه برای توضیح عمل تقویت کنندههای کاتالیزورهای مناسب است. تقویت کننده ها موادی هستند که فعالیت کاتالیزور ها را زیاد میکنند. مثلا در سنتز آمونیاک
اگر کاتالیزورآهن با مقدار کمی پتاسیم یا وانادیم آمیخته شده باشد، بیشتر موثر واقع میشود.
چگونه گاز طبیعی قابل مصرف می شود
| چگونه گاز طبیعی قابل مصرف می شود |
پردازش گازطبیعی |
تبلور
انتخاب حلال مناسب نکته اساسی و مهم در عمل تبلور محسوب می شود. حلال مناسب حلالی است که در دمای معمولی جسم را به مقدار جزئی در خود حل کند، ولی در گرما و به ویژه در دمای جوش، این انحلال به آسانی صورت گیرد.
عامل دیگر در انتخاب حلال مناسب، توجه به قطبیت آن است که با توجه به ساختمان ماده مورد نظر انتخاب می شود.
زیرا ترکیبات قطبی در حلالهای قطبی و ترکیبات غیر قطبی در حلالهای غیر قطبی حل می شوند.
به هنگام انتخاب حلال مناسب برای تبلور، به نکات زیر توجه کنید:
حلال در دمای معمولی (دمای آزمایشگاه) نباید ترکیب را حل کند، اما در نقطه جوش خود باید حداکثر ترکیب یا تمام آن را در خود حل کند.
نقطه جوش حلال نباید از نقطه ذوب ترکیب مورد نظر بیشتر باشد. زیرا در این صورت، پیش از اینکه دمای حلال به نقطه جوش آن برسد، جسم در حلال ذوب می شود. (در پدیده تبلور، جسم باید در حلال حل شود).
حلال و جسم حل شده نباید با هم واکنش بدهند.
تا حد امکان نقطه جوش حلال پایین باشد تا به آسانی تبخیر شود.
مراحل متوالی زیر، پس از انحلال جسم جامد در حلال باید اجرا شود:
چنانچه محلول به شدت رنگی و یا ناخالص باشد، گرم کردن را قطع کنید پس از اینکه محلول، اندکی خنک شد، کمی پودر زغال به آن اضافه کنید. زغال به دلیل دارا بودن سطح فعال زیاد می تواند ناخالصیها و رنگ را به خود جذب کند. سپس مجددا محلول را گرم کنید.
به منظور جداسازی ناخالصیهای نامحلول، محلول را گرم و صاف کنید.
برای اینکه بلورها پدیدار شوند محلول صاف شده را به تدریج سرد کنید.
بلورها را به وسیله صاف کردن جدا کنید.
بلورها را با مقدرا کمی حلال سرد بشویید.
بلورها را خشک کنید.
در تبلور، برای ظاهر شدن از چند روش استفاده می شود:
یک میله شیشه ای (همزن) را از سطح مایع و کنار آن به جدار ظرف بسایید(خراش دهید). حرکت میله باید به صورت عمودی و سریع باشد. به نظر می رسد که با عمل سایش، به مولکولهای جسم انرژی داده می شود و این انرژی باعث نزدیک شدن مولکولها به یکدیگر می شود و به این ترتیب، تشکیل هسته اولیه آسان می شود.
ظرف حاوی محلول را به وسیله قراردادن آن در حمام آب و یخ یا در یخچال سرد کنید.
یک تکه از بلور ترکیب را به عنوان هسته اولیه در ارلن مایر بیندازید این عمل را بذرافشانی و تکه بلور را بذر می نامند.
شناخت روش های آموزش محیط زیست به کودکان
 پژوهشگران معتقدند بهترین شیوه نهادینه کردن عادت های مثبت، آموزش، آن هم آموزش این عادت ها از دوران کودکی است. حفاظت از محیط زیست هم عادتی است که باید از کودکی آموخته شود تا به یک باور ذهنی تبدیل شود. این باور کودک را موظف می کند تا از یگانه زیستگاهی که در آن زندگی می کند به بهترین وجه ممکن پاسداری کند.
پژوهشگران معتقدند بهترین شیوه نهادینه کردن عادت های مثبت، آموزش، آن هم آموزش این عادت ها از دوران کودکی است. حفاظت از محیط زیست هم عادتی است که باید از کودکی آموخته شود تا به یک باور ذهنی تبدیل شود. این باور کودک را موظف می کند تا از یگانه زیستگاهی که در آن زندگی می کند به بهترین وجه ممکن پاسداری کند.آنچه در پی می خوانیم نکاتی ساده و عملی برای آشنا کردن کودک با محیط زیست و حفاظت از آن است.
استفاده بهینه از کاغذ ؛ نقاشی کردن یکی از نخستین مهارت ها و علایق کودکان است. اغلب کودکان به محض آنکه بتوانند قلم به دست بگیرند، نقاشی می کشند. بنابراین نخستین آموزش ها باید از همین نقطه آغاز بشود. به کودک توضیح بدهیم مدادی که با آن نقاشی می کند چطور ساخته شده است. سپس به او یاد بدهیم که با استفاده بهینه از مداد رنگی ها و نتراشیدن بی رویه آنها، می تواند به حفاظت از جنگل ها و درختان کمک کند.
گام بعدی برگه های نقاشی است. علاوه بر دفتر نقاشی که برای او می خریم، برگه های باطله یی که یک روی آنها سفید و قابل استفاده است را دور نریزیم و روی میز کودک، کنار مداد رنگی های او قرار بدهیم تا برای نقاشی از این برگه ها استفاده کند. شیوه درست شدن کاغذ را برای او توضیح بدهیم و سپس به او شرح بدهیم که با استفاده مناسب از کاغذها می تواند مانع از قطع درختان برای تولید کاغذ بشود.
بازیافتی ها را دریابیم؛ با جمع آوری وسایل دورریختنی منزل یا وسایل شخصی فرزندمان و استفاده مجدد از آنها مساله بازیافت و جمع آوری زباله ها را به او بیاموزیم. به طور مثال با کمک فرزندمان قوطی های نوشابه (Can) را جمع کنیم. آنها را بشوییم و با بریدن در آنها، از این قوطی ها جا قلمی برای روی میز تحریر فرزندمان درست کنیم. از این قوطی ها یا ظرف های پلاستیکی مواد شوینده می توانیم به عنوان گلدان هم استفاده کنیم.
بازی با طبیعت؛ برای آنکه کودک را با طبیعت و وجود موجودات مختلف در طبیعت یا نعمت های طبیعی مثل باران آشنا کنیم، بازی ها و آزمایش های ساده یی را همراه او انجام بدهیم. مثلاً هنگام بارش باران ظرف های خالی مواد شوینده، بطری های خالی شیر و... را جلوی پنجره یا حیاط بگذاریم تا آب باران داخل شان جمع شود. سپس از فرزندمان بخواهیم با آب باران جمع شده در این ظرف ها، گلدان های منزل را آبیاری کند. این آزمایش به صورت ساده و عملی جمع شدن آب باران در دریاها و اقیانوس ها را به کودک نشان می دهد. علاوه بر این او را با فواید نزولات آسمانی آشنا می کند.
حفاظت از انرژی را بیاموزیم؛ چند لحظه قبل از شروع برنامه مورد علاقه او تلویزیون یا رادیو را از برق بیرون بکشید. در جواب اعتراض او توضیح بدهید که اگر از انرژی برق یا هر انرژی دیگری بی رویه استفاده کنیم، هنگام نیاز ضروری به آن، این انرژی در اختیار ما نخواهد بود. تلویزیون یا رادیو را روشن کنید تا این نبودن برق و لذت دوباره داشتن برق و تماشای تلویزیون در ذهن او بماند. درباره انواع انرژی، شیوه های تولید آن و... برای او توضیح بدهید.
دانه بکاریم؛ برای آنکه فرزندمان مفهوم حفاظت از خاک و آب را به درستی دریابد، همراه او باغبانی کنیم. با کاشتن تخم سبزی ها یا دانه هایی مثل آفتابگردان در حیاط منزل یا گلدان او را با مراحل رشد گیاه، نیاز گیاه به خاک خوب، آب سالم، نور خورشید و... آشنا کنیم. برای درک بهتر او، بهتر است یک نمونه کوچک را با خاک نامناسب (مثل خاک آغشته به نفت) یا آب ناسالم (آب مخلوط شده با مواد شوینده) رشد بدهیم تا کودک به خوبی تاثیر آلودگی آب و خاک بر گیاهان را ببیند. مقایسه گیاه سالم و بیمار مفاهیم را به خوبی به او می آموزد. بازدید از گلخانه ها و پارک ها ارتباط او را با محیط زیست بیشتر می کند.
با آشغال ها بازی کنیم؛ آموزش جدا کردن زباله های خشک و تر و جمع آوری و دفع زباله ها نکته دیگری است که باید به خوبی به کودک آموخته شود. برای این کار چند کیسه زباله انتخاب کنیم و آن را در محل مناسبی بگذاریم. روی هر کیسه با برچسب، نوع زباله یی را که باید درون آن بریزیم مشخص کنیم. مثلاً مواد پلاستیکی، قوطی های فلزی، ظرف های شیشه یی و کاغذ (برای جلوگیری از آلودگی بهتر است فقط زباله های خشک را برای این کار جمع آوری کنیم). سپس از فرزندمان بخواهیم تا برای جمع آوری و تفکیک زباله ها ما را همراهی کند. به این ترتیب او را با مساله جمع آوری، تفکیک و دفع صحیح زباله آشنا کرده ایم.
کاردستی بسازیم؛ ابتدا برای فرزندمان توضیح بدهیم که پارچه، چوب، کاغذ و... چطور تهیه می شوند. سپس با استفاده از پارچه های اضافی برای او وسایل مختلفی مثل عروسک، جاجورابی، جامدادی و... بسازیم. هر چقدر با استفاده از مواد به ظاهر دورریختنی مثل کاغذ، پارچه، چوب، پلاستیک (مثل ظرف های خالی مواد شوینده) و... وسایل جدید بسازیم به همان نسبت ارزش مواد را به فرزندمان آموخته ایم. از طرفی به او می آموزیم که به جای آشغال سازی می توان از موادی که به ظاهر دورریختنی به نظر می رسند، وسایل قابل استفاده ساخت.
یک روز بدون انرژی؛ ماهی یک بار، روز بدون انرژی در منزل اعلام کنیم. در این روز خاص بازی با اسباب بازی ها یا استفاده از وسایل برقی یا باتری یی، تماشای تلویزیون و... استفاده از تلفن همراه و... ممنوع است. در این روز فقط باید از وسایلی که با انرژی کار نمی کنند، استفاده کنیم (مثلاً بازی با اسباب بازی های غیربرقی و باتری یی و...). با این کار فرزندمان ارزش و اهمیت انرژی ها، جایگاه آنها در زندگی امروز و ضرورت حفظ این منابع و جلوگیری از به هدر رفتن این منابع با ارزش را می آموزد.
گردش علمی؛ هفته یی یک بار گردش علمی ترتیب بدهیم یا اینکه در برنامه های تفریحی خانواده، آموزش های علمی را به طور غیرمستقیم بگنجانیم.
مطالعه؛ با خرید کتاب های علمی درباره طبیعت، حیات وحش، حفاظت از محیط زیست، زباله ها و راه های بازیافت و دفع زباله و... او را به طور غیرمستقیم به سوی آشنایی با مفاهیم علمی و شیوه های حفاظت از محیط زیست سوق می دهیم. فراموش نکنیم برای مطالعه فرزندمان را اجبار نکنیم؛ همین که کتاب ها را در معرض دید او بگذاریم و همراه او برای خرید کتاب به کتابفروشی برویم، کافی است.
www.cnn.com
دریافت اطلاعات ایمنی مواد شیمیایی
با سلام
لطفا جهت دریافت اطلاعات ایمنی مواد شیمیایی به این لینک مراجعه فرمایید.
کاهش NOx با کاتالیست انتخابگر یا SCR
کاهش NOx با کاتالیست انتخابگر یا SCR
اما یکی از بهترین روش ها استفاده از کاتالیزور برای حذف این الاینده خطرناک با روش SCR است.
در این روش از یک بستر کاتالیستی همراه با آمونیاک برای کاهش NOx استفاده میشود.
یک سیستم SCR به طور ابتدایی شامل شبکه تزریق آمونیاک و یک بستر کاتالیست درون یک رآکتور شیمیایی است.
انواع مختلفی از کاتالیستها در SCR استفاده میشود فلزات متنوعی میتوانند در رنج دمایی پایین (550-350 درجه فارنهایت) استفاده شوند مانند پنتواکسید وانادیوم. تیتانیوم دی اکسید نیز یک کاتالیست رایج برای رنج دمایی 500-800 درجه فارنهایت است.
سیستمهایSCR در حال حاضر بر روی کارخانجات و کورههای زغال گرم شده نصب شده و نتایج تنظیم کنترل دقیق NOx را حاصل کرده است.
سیستم SCR قادر به کاهش NOx بین 70 تا 90% خواهد بود که بالاترین میزان کاهش NOx در میان روش های حذف آن است.




