شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.اندازهگیری گازهای خطرناک و سمی
اندازهگیری گازهای خطرناک روز به روز در صنعت امروز اهمیت بیشتری پیدا میکند. کارخانهها کمیتهای برای ایجاد استانداردهای محیطی تشکیل دادهاند و شرایط و استانداردهای بسیار سختگیرانهای برای جلوگیری از انتشار این گازها تعیین شده است. ABB(uk) سیستمی دایمی را پیشنهاد داده است که اندازهگیری گازها را با کیفیت بسیار بالا انجام میدهد و با اینکه هزینه بسیار اندکی را در طول دوره کار کارخانه تحمیل میکند، اما تحلیلگرهای NDIR و FTIR بسیار قدرتمندی دارد که توانایی مانیتورینگ خودکار و از راه دور را نیز دارد. فناوری قدرتمند FTIR میتواند به صورت هم زمان بیش از ۱۲ نوع از ترکیبات گازی شامل HCL، CO، NO، SO۲، NO۲، N۲O، NH۳ و H۲O، HF، O۲ و هیدروکربنها را شناسایی و اندازهگیری کند.
سدیم ( Sodium )
سدیم عنصری فلزی نرم به رنگ سفید- نقره ای است و شدیدا” از لحاظ شیمیایی فعال است. این عنصر در سال ۱۸۰۷ توسط Humphry Davy دانشمند انگلیسی کشف گردید سدیم به صورت غیر ترکیبی در طبیعت یافت نمی شود.ترکیبات این عنصر در سنگها, خاک, اقیانوسها , دریاچه های نمک و آب های معدنی یافت می شود.این فلز معمولا” از طریق الکترولیز کلرید سدیم ، بوراکس و کریولیت مذاب تهیه می شود.
فراونی فلز سدیم در ستاره ها و خورشید زیاد است. خطوط D فلز سدیم در طیف های خورشیدی به صورت برجسته ای دیده می شود. سدیم چهارمین عنصر از نظر فراوانی در طبیعت است که میزان ۲٫۶ درصد از ترکیب پوسته زمین را شامل می شود. این عنصر بیشتر در فلزات آلکالی یافت می شود. این عنصر توسط الکترولیز کلرید سدیم حاصل می شود. این روش ارزانترین روش برای تولید فلز سدیم در چندین سال گذشته می باشد.
بیشترین ترکیب این فلز کلرید سدیم است که در مواد معدنی مثل جوش شیرین و نیترات سدیم و فلوئورید آلومینیوم و سدیم ، آمفیبولها ، زئولیت و غیره وجود دارد.
سدیم فلزی واکنش پذیر است که
مولاریته
مولاریته یا غلظت مولار که با (M) نشان داده میشود، عبارت است از تعداد وزن مولکول گرم (یا تعداد مول) از یک جسم حل شده در یک لیتر محلول. مول کمیت اساسی است که یک شیمیدان تجزیه با آن سر و کار زیادی دارند. یک مول برابر با 6.023X1023 مولکول از یک جسم است. اصطلاح مول در یک مفهوم وسیع برای توصیف مقادیر ترکیبات مولکولی ، عناصر آزاد و یونها بکار میرود. به بیان دیگر وزن تعداد 6.023X1023 عدد مولکول ، یون یا عنصر برابر با 1 مول مولکول ، یون یا عنصر است که به صورت مولکول گرم ، یون گرم یا عنصر گرم نامیده میشود.
برای محاسبه غلظت یک محلول بر حسب مولاریته ابتدا باید تعداد مولهای جسم حل شده را بدست آوریم. تعداد مولهای جسم حل شده از تقسیم کردن وزن آن (برحسب گرم) به وزن فرمولی بدست میآید.
تهیه محلولهای مولار
برای تهیه یک محلول مولار از یک ترکیب باید یک مول از آن را وزن کرده و به مقدار کافی به آن آب اضافه کنیم تا دقیقا یک لیتر محلول بدست آید. به عنوان مثال برای تهیه یک محلول 2M از اسید سولفوریک باید گرم 196.16=98.08×2 از اسید سولفوریک را در مقدار کافی آب حل کنیم تا یک لیتر محلول 2M اسید سولفوریک بدست آید. وقتی یک محلول مایع تهیه میکنیم، حجم محلول به ندرت مساوی مجموع حجمهای اجزا خالص سازنده آن است. معمولا حجم نهایی محلول بیشتر یا کمتر از مجموع حجمهای اجزا سازنده آن است.
از این رو برای تهیه یک محلول معین عملا نمیتوانیم مقدار حلال لازم را پیشبینی کنیم. برای تهیه محلولهای مولار و سایر محلولهایی که بر اساس حجم کل است، معمولا از بالنهای حجمسنجی استفاده میشود. در این صورت برای تهیه یک محلول مقدار دقیق ماده حل شونده را در بالن جای میهیم و با دقت آن قدر آب میافزائیم و بطور مداوم و با احتیاط هم میزنیم تا سطح محلول به خط نشانهای که روی گردن بالن مشخص شده برسد.
محاسبه غلظت یک محلول بر حسب مولاریته
معرفی گروههای عاملی و روشهای شناسایی

شناساگرهای شیمیایی
شناساگرهای شیمیایی
در حالت کلی ، شناساگرها موادی رنگی هستند که معمولا از مواد گیاهی اخذ میشوند و میتوانند به شکل اسیدی یا بازی موجودیت یابند. شناساگرها برای شناسایی اسیدها و بازها به ما کمک میکنند.

برای تعیین نقطه پایان در حین تیتر کردن از ترکیبات شیمیایی مشخص استفاده میشود که در نزدیکی نقطه تعادل در اثر تغییر غلظت مواد تیترشونده شروع به تغییر رنگ میکنند. این ترکیبات ، مواد رنگی شناساگر میباشند. به عبارتی دیگر ، شناساگرها ماده ای رنگی هستند که رنگ آنها در محیط اسیدی و قلیایی با هم تفاوت دارد.

یکی از ساده ترین راه تخمین کمی PH ، استفاده از یک شناساگر است. با افزودن مقدار کمی از یک شناساگر به یک محلول ، تشخیص اسیدی یا بازی بودن آن ممکن میشود. در صورت مشخص بودن PH ، تغییر شناساگر از یک شکل به شکل دیگر ، با توجه به رنگ مشاهده شده ، میتوان تعیین کرد که PH محلول کمتر یا بیشتر از این مقدار است. شیمیدانها از این گونه مواد برای شناسایی اسیدها و بازها کمک میگیرند.
شناساگرهای زیادی وجود دارد که معروفترین آنها لیتموس (تورنسل) است که در محیط اسیدی ، قرمز ، در محیط بازی ، آبی و در حدود خنثی بنفش رنگ است. تغییر رنگ آن در نزدیکی PH برابر ۷ رخ میدهد. در هر حال تغییر رنگ ناگهانی نیست. فنل فتالئین ، معرف دیگری است که بیشتر برای بازها قابل استفاده است. این ماده جامدی سفید رنگ است که در آزمایشگاه محلول الکلی آن را بکار میبرند. این محلول در محیط اسیدی رنگ و در محیط قلیایی رقیق ارغوانی است.
میتوان از آب کلم سرخ نیز بهعنوان یک شناساگر اسید و باز استفاده کرد. از آمیختن شناساگرهای مختلف با یکدیگر نوار کاغذی بدست میآید که با یک مقیاس رنگ مقایسهای همراه است و برای اندازه گیریهای تقریبی PH بطور گسترده کاربرد دارد.
● انواع شناساگرها
دو نوع شناساگر داخلی و خارجی را معرفی میکنیم:

▪ شناساگر داخلی
اگر به محلول تیتر شونده ، چند قطره از یک شناساگر افزوده شود و پس از پایان عمل تغییر رنگ در محلول ایجاد شود، چنین شناساگری را شناساگر داخلی یا درونی نامند.
▪ شناساگر خارجی
در برخی حالات قبل از آن که نقطه پایان به ظهور برسد، بین شناساگر و محلول تیتر شونده یک واکنش صورت میگیرد و در این حالت نقطه پایان بسیار سریع پدیدار میشود، مثل تیتر کردن فسفات با استات اورانیل در حضور شناساگر فروسیانور پتاسیم ، فروسیانور پتاسیم با یونهای اورانیل قبل از رسیدن به نقطه پایان واکنش میدهد.
برای بدست آوردن نتیجه صحیح و خوب باید به دفعات لازم چند قطره از محلول بالای رسوب ( یا محلولی که پس از صاف کردن رسوب بدست میآید ) را در فاصله زمانهای مساوی ، روی یک قطعه کاغذ صافی با شناساگر سیانور پتاسیم آزمایش کرد. چنین شناساگری ، شناساگر خارجی نامیده میشود. 
فاصله تغییر PH و تغییر رنگ برخی از شناساگرهای مهم اسید و باز که متداولند در جدول بالا آمده است.
تعیین اکسید پتاسیم و سدیم
مواد مورد نیاز:
1-اسید کلریدریک غلیظ 37 درصد (d = 1.19)
2-اسید فلوئوریدریک غلیظ
3-اسید پرکلریک (HClO4)
4-محلول نیترات آلومینیوم : مقدار 208.5 گرم نیترات آلومنیوم را در آب مقطر حل نموده و به حجم یک لیتر برسانید.
5-محلول ppm Na2O 1000 : مقدار 1.8859 گرم از کلرور سدیمی که قبلا به مدت 2 ساعت در اون و در حرارت 105 تا 110 درجه سانتیگراد گذاشته شدهاست را توزین نموده و در آب مقطر حل نمائید و حجم را به یک لیتر برسانید.
6-محلول ppm K2O 1000 : مقدار 1.5829 گرم از کلرور پتاسیمی که قبلا به مدت 2 ساعت در اون و در حرارت 105 تا 110 درجه سانتیگراد گذاشته شده است را توزین نموده و در آب مقطر حل نمائید و حجم را به یک لیتر برسانید.
7-محلول 5ppmNa2O و 10ppmK2O: مقدار 5 میلیلیتر از محلول 1000ppmNa2O و 10 میلیلیتر از محلول 1000ppmK2O را در یک بالن ژوژه یک لیتری به حجم برسانید .
وسائل مورد نیاز:
اندازه گیری گازکربنیک CO2 در آب
اندازه گیری گازکربنیک CO2 در آب :
گاز کربنیک جزو گازهایی است که ضمن انحلال در آب با عوامل موجود در آن بصورت ترکیب در آمده و یا با ترکیب با آب قسمتی بصورت اسید کربنیک در آن حل شده و قسمتی دیگر به یونهای کربنات و بی کربنات تبدیل می شود. در آبهای طبیعی که PH آنها نزدیک به 8 باشد تعادلی بین کربنات کلسیم و بیکربنات کلسیم موجود در آب در اثر وجود گاز کربنیک آزاد بوجود می آید که مانع ازاین است که کربنات کلسیم از صورت محلول بصورت جامد در آید و رسوب نماید.آن قسمت از گاز کربنیک آزاد که تعادل کربناتی را برقرار می سازد گاز کربنیک متعادل کننده و مقداری که زیادتر از آن است گاز کربنیک آزاد خوانده می شود.بنابراین گازکربنیک موجود در آب شامل گازکربنیک آزاد ،گازکربنیک متعادل کننده و گازکربنیک متعلق به کربنات ها و بی کربنات هاست و مجموع اینها گازکربنیک کل خوانده می شود. CO2 محلول در آب را میتوان با کمک یک قلیای قوی اندازه گیری نمود. در این فعل و انفعالات CO2 آزاد به بیکربنات تبدیل خواهد شد.
مواد مورد نیاز :
پی وی سی - PVC
"پلی وینیل کلرید" که بیشتر با عنوان "pvc" یا "وینیل" شناخته شده است به طور اتفاقی در قرن نوزدهم توسط "هنری ویکتور ریگنالت" و "ایگن بایومان" کشف شد.این پلیمر گرمانرمی سخت.واکنش ناپذیر.دارای تنوع بسیار زیاد و ارزان قیمت است که در جامعه مدرن کاملا فراگیر شده و یکی از ارزشمندترین محصولات صنایع شیمیایی و پلیمری است.
تنوع محصولات ساخته شده از این پلیمر بسیار گسترده است:از صفحه های گرامافون تا لوله های اب و زه کشی.بطری ها.کارت های اعتباری.مواد ساختمانی.محصولات مصرفی.بسته بندی های یک بار مصرف و بسیاری از محصولات روزمره دیگر و حتی چرم مصنوعی نیز از این پلیمر تهیه می شود.در حقیقت به هرجا بنگریم محصولاتی از این پلاستیک دیده می شود.
بیشتر "پلی وینیل کلرید" ساخته شده در کاربردهای ساختمان سازی استفاده می گردد.
در حالیکه اکثر پلاستیک ها از نفت خام ساخته می شوند فقط 40 درصد PVC از نفت خام است و 60 درصد باقی مانده ان را کلر تشکیل می دهد که از نمک طعام حاصل می شود.کلر خواص مفیدی از قبیل مقاومت در برابر اتش و دوام را به پلیمر می دهد.این پلیمر بر حسب حجم تولیدی ان در رده دوم بعد از "پلی اتیلن" جای دارد."پلی وینیل کلرید" به مجموعه ای از افزودنی ها نیاز دارد تا ان را قابل استفاده کند.سرب.کادمیم یا ترکیبات الی قلع به عنوان پایدار کننده.فتالات ها به عنوان نرم کننده و سایر مواد شیمیایی به عنوان رنگ دهنده ها.بازدارنده های اتش.پرکننده ها و ضد اکسنده ها استفاده می شوند.
متیل اورانژ چیست و چگونه تشکیل می شود؟
متیل اورانژ ترکیب به شدت رنگی است و در رنگ کردن و چاپ کردن پارچه ها به کار می رود.شیمیدانان از متیل اورانژبه عنوان معرف در تیتراسیون باز ضعیف با اسیدهای قوی استفاده می کنند.رنگ این ماده از قرمز تا زرد مایل به نارنجی (4.4-3.1 PH=) تغییر می کند.
تغییر مسیر الکترونهای محدود در مولکول وقتی که اتم هیدروژن به آن اضافه یا از آن جدا می شود ؛ سبب تغییرات رنگی PH متیل اورانژ می شود .ساختمان این ماده در محیط اسیدی به صورت زیر می باشد.
این مولکول رنگ سبز –آبی را جذب می کند در نتیجه محلول به رنگ قرمز دیده می شود.توجه داشته باشید که نیتروژن دارای بار مثبت پیوند دوگانه دارد .
در محیط بازی ؛ یک یون هیدروژن از پل N-N میان حلقه ها حذف شده والکترونهایی که قبلاًبرای اتصال این هیدروژن به کار می رفتند بار مثبت اتم نیتروژن انتهایی را خنثی می کنند به طوری که آن اتم نیتروژن دیگر نمی تواند پیوند پی تشکیل دهد .محلول متیل اورانژ در محیط بازی زرد می شود.
متیل اورانژ چگونه تشکیل می شود؟
از واکنش سولفانیلیک اسید ؛سدیم نیتریت و دی متیل آلانین ؛ متیل اورانژ ساخته می شود.ابتدا ؛سولفانیلیک اسید در محلول اسیدی رقیق حل شده ؛سپس سدیم نیتریت به آن اضافه می شودو نمک دی آزونیوم تشکیل می شود.
تجزیه عنصری
تجزیه عنصری
عنا صر متداول موجوددرترکیبات آلی کر بن هیدروژن واکسیژن می باشد گاهی عناصر دیگری نظیر نیتروژن- گوگرد-اکسیژن و هالوژن هاهم درآنها یافت می شوند.برای اکسیژن آزمایش ساده ای وجود نداردو عناصر دیگر با پیوند کوالانسی در اتصال هستندو بنابراین با آزمایش های یونی معمولی مستقیما جواب نمی دهند.ولی اگر جسم آلی مجهول با سدیم مذاب ذوب شود در اگثر موارد طوری ترکیب می شود که NوSوXآن به یونهای CNوSوCNSوXتبدیل می شود.پس از آنکه سدیم اضافی دقیقا از بین برده شد محلول آبی را که محتوی این یونهاست به روش معمولی معدنی تجزیه می کنند.توضیح کامل تری در این مورد وجود دارد که در زیر به آن می پردازیم.
کربن هیدروژن واکسیژن
برای اثبات وجود کربن و هیدروژن نمونه رابا پودر خشک مس(II) اکسید حرارت داده که منجر به ایجاد کربن دی اکسید وآب می شود . حضور کربن در نمونه با عبور دادن گاز های ایجاد شده از درون محلول با ریم یا کلسیم هیدروکسید مشخص نمی شود که دراین صورت رسوب کربنات مربوطه حاصل می شود . هیدروژن را می توان با ایجاد قطره های آب متراکم شده روی قسمت بالایی لوله تشخیص داد . هیچ آزمایش کیفی برای اثبات وجود اکسیژن در ترکیبات آلی وجود ندارد برای تعیین اکسیژن باید تجزیه کمی صورت بگیرد .دراین روش اگر اگر مجموع درصد تمام عناصر تشکیل دهنده ترکیب کمتر آن تا 100 مربوط به در صداکسیژن است .
نیتروژن گوگرد و هالوژن ها
ادامه مطلب ...معرف های شیمیایی
۱-تهیه محلول هلیانتین(متیل اورانژ)
معرف اسید و بازها
یک دهم گرم آن را در100میلی لیتر آب مقطرحل می کنیم.
۲-تهیه محلول فنل فتالئین
2گرم پودر فنل فتالئین رادر50میلی لیتر الکل حل کرده با آب مقطر به100 میلی لیتر می رسانیم.
۳-تهیه محلول تورنسل
معرف اسیدهاو بازها
یک گرم تورنسل را در کمی آب مقطر حل کرده و حجم آنرا به 100میلی لیتر می رسانیم.
ادامه مطلب ...انرژی های یونش بالاتر
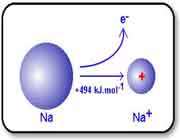
با اندکی مطالعه راجع به انرژی یونش و تشکیل یون های مختلف عناصر، متوجه می شوید که سدیم، منیزیم و آلومینیوم یون های Na+ و Mg2+ و Al3+ تشکیل می دهند. اما آیا تا کنون از خود پرسیده اید که چرا سدیم، یون های Na2+ یا حتی Na3+ تشکیل نمی دهد؟
جواب این سؤال می تواند از انرژی دومین، سومین و ... یونش عناصر به دست آید. به عنوان مثال، انرژی اولین یونش سدیم، انرژی لازم برای برداشتن یک الکترون از یک اتم سدیم خنثی است:
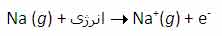
انرژی دومین یونش سدیم، انرژی لازم برای برداشتن یک الکترون دیگر از یون Na+ در حالت گازی است که یک یونNa2+تشکیل می دهد:
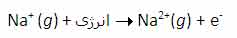
سومین انرژی یونش سدیم نیز به همین ترتیب است:
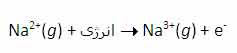
بنابراین انرژی لازم برای تشکیل یون Na3+ در فاز گازی، جمع انرژی های یونش اول، دوم و سوم این عنصر است.
ادامه مطلب ...electron affinity یا الکترون خواهی
همان گونه که می دانیم، انرژی یونش، تمایل یک اتم خنثی برای مخالفت با از دست دادن الکترون را اندازه می گیرد. یعنی گرفتن یک الکترون از اتم، مستلزم صرف انرژی است (این فرایند، گرماگیر است). برای مثال، برداشتن یک الکترون از اتم فلوئور خنثی و تشکیل یون با بار مثبت، مقدار قابل ملاحظه ای انرژی لازم دارد:
F(g) F+(g) + e-  Ho = 1681.0 kJ/mol
Ho = 1681.0 kJ/mol
الکترون خواهی یک عنصر، مقدار انرژی خارج شده از آن است که در طول این فرایند، یک اتم خنثی در فاز گازی، یک الکترون اضافی به دست می آورد تا یون با بار منفی تشکیل دهد. برای مثال، زمانی که اتم فلوئور در حالت گازی، الکترون به دست می آورد تا یون منفی فلوئور تشکیل دهد، انرژی آزاد می کند (تشکیل این پیوند بین اتم فلوئور و الکترون خارجی، گرماده است):
F(g) + e-  F-(g)
F-(g)  Ho = -328.0 kJ/mol
Ho = -328.0 kJ/mol
اندازه گیری الکترون خواهی، مشکل تر از انرژی یونش است و معمولاً با ارقام با معنی کم تری شناسایی می شود. الکترون خواهی عناصر گروه های اصلی جدول تناوبی در شکل 1 نشان داده شده است. می توان از این شکل، اطلاعات زیر را فهمید:
ادامه مطلب ...اندازه گیری کلراید
مواد مورد نیاز:
محلول نیترات نقره 0.05 نرمال :8.4938 گرم نیترات نقره را که قبلا در اون در حرارت 105 درجه سانتیگراد حداکثر به مدت یک ساعت قرارداده شده و به وزن ثابت رسیده را در آب مقطر حل نموده و حجم را به یک لیتر برسانید و با محلول 0.05 نرمال کلرور سدیم یا پتاسیم استاندارد نمائید .همچنین میتوانید یک عدد تیترازول 0.1 نرمال نیترات نقره را در یک بالن ژوژه 2 لیتری منتقل کرده و به حجم برسانید .
تهیه محلول 0.05 نرمال کلرور سدیم : 2.9222 گرم از کلرور سدیمی که قبلا در اون در حرارت 105 درجه سانتیگراد به مدت یک ساعت خشک شده است ، در آب مقطر حل نموده و به حجم یک لیتر برسانید .
تهیه محلول 0.05 نرمال کلرور پتاسیم : 3.7277 گرم از کلرور پتاسیمی که قبلا در اون در حرارت 105 درجه سانتیگراد به مدت یک ساعت خشک شده است، در آب مقطر حل نموده و به حجم یک لیتر برسانید .
محلول 5 درصد کرومات پتاسیم 50g/litK2CrO4 مقدار 12.5 گرم کرومات پتاسیم را در 250 میلیلیتر آب مقطر حل نمائید . برای تهیه محلول 10 کرومات پتاسیم 100g/litK2CrO4 مقدار 25 گرم کرومات پتاسیم را در 250 میلیلیتر آب مقطر حل نمائید
معرف فنل فتالئین : 0.5 گرم فنل فتالئین را در 100 میلیلیتر اتانول حل نمائید و طبق استاندارد ASTM، یک گرم فنلفتالئین را در یک لیتر اتانول 96 درصد حل نمائید .
محلول اسید نیتریک 0.1 نرمال : 1.4 میلیلیتر اسید نیتریک غلیظ را با 200 میلیلیتر آب مقطر مخلوط نمائید .
محلول هیدروکسید سدیم 0.1 نرمال :1 گرم هیدروکسید سدیم (NaOH) را در 250 میلیلیتر آب مقطر حل نمائید .
وسائل مورد نیاز:
بشر 100 و 250 میلیلیتری
قیف بوخنر و ارلن مایر خرطومی
بالن ژوژه 250 میلیلیتری
پی پت حبابدار 10 و 25 میلیلیتری
ارلن مایر 250 میلیلیتری
کاغذ صافی بافت ریز (باند آبی) یا واتمن 42
دستورالعمل آزمایش:
1- اگر درصد کلر در نمونه کم باشد: مقدار 5 گرم از نمونه را به دقت توزین نموده و به یک بشر 250 میلیلیتری منتقل نمائید . 75 میلیلیتر آب مقطر اضافه نموده و تا نزدیک نقطه جوش حرارت دهید . سپس محلول را در حرارت ملایم در زیر نقطه جوش به مدت 15 دقیقه دهید و در این مدت محلول راهم بزنید. محلول را کناری بگذارید تا سرد شده و به درجه محیط برسد. در مرحله بعد محلول سرد شده را با قیف بوخنر و با کاغذ صافی باند آبی توسط پمپ خلاء صاف نمائید و چند بار با آب شستشو دهید .در تیتراسیون با روش مور باید محلول خنثیباشد (PH=7). درصورت نیاز باید PH محلول را تنظیم کرد. پس از تنظیم PH یک میلیلیتر معرف کرومات پتاسیم 5 درصد اضافه کنید تا رنگ محلول زردشود. ارلن مایر را روی یک صفحه کاغذ سفید قرارداده و با محلول 0.05 نرمال نیترات نقره تیتر کنید تا رنگ محلول از زرد به قرمز آجری تغییرکند. حجم نیترات نقره مصرفی را یادداشت کنید (V Sample) . سپس یک شاهد از مقطر و 1 میلی لیتر کرومات پتاسیم 5 درصد تهیه و با نیترات نقره 0.05 نرمال تیتر کنید تا از زرد به قرمز آجری تغییر رنگ دهد. نیترات نقره مصرفی را یادداشت کنید (V Blank) .
2- اگر درصد کلر در نمونه زیاد باشد: یک گرم از نمونه را با دقت توزین نموده و به یک بشر 100 میلیلیتری منتقل نمائید .75 میلیلیتر آب مقطر اضافه نموده و تا نزدیک نقطه جوش حرارت دهید. سپس محلول را در حرارت ملایم در زیر نقطه جوش به مدت 15 دقیقه دهید و در این مدت محلول را هم بزنید. رسوب را در یک بالن ژوژه 250 میلیلیتری با کاغذ صافی بافت ریز (باند آبی) صاف نموده و آن را چندین بار با آب مقطر شستشو دهید . پس از سرد شدن به حجم رسانده و 25 میلیلیتر از محلول را به یک ارلن مایر 250 میلیلیتری منتقل نموده و حدود 100 میلیلیتر آب مقطر اضافه نموده و ابتدا PH محلول را تنظیم نموده و سپس کرومات پتاسیم اضافه کرده و با محلول نیترات نقره 0.05 نرمال تیتر نمائید . حجم نیترات نقره مصرفی را یادداشت کنید (V Sample). یک شاهد از 100 میلیلیتر مقطر و 1 میلیلیتر کرومات پتاسیم تهیه کرده و با نیترات نقره 0.05 نرمال تیتر کنید تا از زرد به قرمز آجری تغییر رنگ دهد. حجم نیترات نقره مصرفی را یادداشت نمائید (V Blank) .
تنظیم PH:
به محلول 3 تا 4 قطره معرف فنل فتالئین اضافه کنید .چنانچه رنگ محلول ارغوانی شد محلول قلیائیاست در اینحالت برای تنظیم PH قطره اسید نیتریک 0.1 نرمال اضافه نمائید تا رنگ محلول صورتی کم رنگ شود. اگر بعد از اضافه کردن فنل فتالئین محلول بی رنگ بود آن را با محلول سود 0.1 نرمال خنثی کنید تا صورتی کمرنگ شود.
محاسبات :
اگر نرمالیته نیترات نقره 0.05 نرمال و وزن نمونه یک گرم باشد، درصد کلر در نمونه برابر است با :
% Cl= (V Sample – V Blank ) (ml) × 0.1773
اگر نرمالیته نیترات نقره 0.05 نرمال و وزن نمونه 5 گرم باشد، درصد کلر در نمونه برابر است با :
% Cl ( V Sample – V Blank ) (ml) × 0.0354
زمانی که درصد کلر در نمونه بالاباشد، حجم محلول 250 میلیلیتر رسانده و 25 میلیلیتر از محلول استفاده میکنند.
اگر نرمالیته نیترات نقره 0.05 نرمال و وزن نمونه یک گرم باشد، درصد کلر در نمونه برابر است با :
% Cl ( V Sample – V Blank ) (ml) × 1.7726
اگر نرمالیته نیترات نقره 0.05 نرمال و وزن نمونه 5 گرم باشد، درصد کلر در نمونه برابر است با :
% Cl ( V Sample – V Blank ) (ml) × 0.3545
استاندارد کردن نیترات نقره :
10 یا 25 میلیلیتر از محلول کلرور سدیم یا پتاسیم تهیه شده را به یک ارلن مایر 250 میلیلیتری منتقل کرده ، 100 میلیلیتر آب مقطر و 1 میلیلیتر کرومات پتاسیم اضافه نموده و با نیترات نقره تیتر نمائید .حجم نیترات نقره مصرفی را یادداشت نمائید .
محاسبات :
اگر از 10 میلیلیتر محلول کلرور سدیم یا پتاسیم 0.05 نرمال استفاده شود نرمالیته نیترات نقره برابر است با :
N AgNO3 = 1/(2 × V AgNO3)
اگر از 25 میلیلیتر از محلول 0.05 نرمال کلرور سدیم یا پتاسیم استفاده شود نرمالیته نیترات نقره برابر است با :
N AgNO3 = 1.25/(V AgNO3)
یادآوری :
نیترات نقره هنگامیکه مورد استفاده قرار نمیگیرد بایستی در مکانی تاریک و در شیشه تیره نگهداری شود زیرا نیترات نقره تجزیه میشود.
تیتراسیون باید در دمای محیط انجام شود زیرا دماهای بالا، انحلال پذیری Ag2CrO4 را بطور قابل ملاحظهای افزایشمیدهد.
اگر از محلول 5 درصد کرومات پتاسیم (50 gr/lit) استفاده شود، باید یک میلیلیتر کرومات پتاسیم و چنانچه از محلول 10 درصد کرومات پتاسیم (100 gr/lit) استفاده شود، باید 5/0 میلیلیتر از کرومات پتاسیم اضافه شود.
نمونه های سیمان و کلینکر و مواد خام معمولا نیازی بهتنظیم PH ندارند و فقط نمونه های با درصد قلیائی بالا، نیاز به تنظیم PH دارند، زیرا قلیائیها باعث افزایش PH محلول میگردند و در نتیجه در محیط قلیائی اکسید نقره رسوب میکند.
برای تهیه شاهد میتوان از 5/0 گرم کربنات کلسیم خالص (CaCO3) و100 میلیلیتر آب استفاده کرد. کربنات کلسیم رسوب بیاثری میدهد که شبیه رسوب AgCl است و در مطابقت ته رنگها به طور مؤثر کمک میکند
سموم کاتالیزور
سموم کاتالیزور
سموم کاتالیزور موادی هستند که کاتالیزورها را از فعالیت باز میدارند. مثلا مقدار کمی آرسنیک توانایی پلاتین را که کاتالیزور تبدیل سولفور دیاکسید ،به سولفور تریاکسید است، از بین میبرد.
احتمالا در این عمل بر سطح پلاتین ، پلاتینم ارسیند تشکیل میشود و فعالیت کاتالیزوری از میان میرود. جذب اتیلن ، کاتالیزور را موقتا مسموم میکند، درحالیکه جذب پلاتین ، کاتالیزور را بطور دائم مسموم میکند.
اختصاصی بودن فعالیت کاتالیزور
فعالیت کاتالیزورها عمدتا بسیار اختصاصی است. در پارهای موارد ، کاتالیزور معین موجب سنتز نوعی محصولات خاص از بعضی مواد میشود، حال آنکه کاتالیزور دیگر موجب سنتز محصولات کاملا متفاوت دیگری از همان مواد میشود. البته در این موارد امکان وقوع هر دو واکنش از لحاظ ترمودینامیکی میسر است. مثلاکربن مونوکسید و هیدروژن بر هم اثر میکنند و بسته به شرایط واکنش و نوع کاتالیزور مصرف شده ، محصولات بسیار متنوعی ایجاد میکنند.
اگر کبالت یا نیکل بعنوان کاتالیزور بکاربرده شود، مخلوطی از هیدروکربنها بوجود میآورد. در این جا نیکل بعنوان یک کاتالیزور نامرغوب عمل میکند.
و اگر مخلوطی از روی و اکسید کرم بعنوان کاتالیزور مصرف شود، از واکنش متانول تولید میشود.
برای این واکنش ، نیکل یک کاتالیزور مرغوب است.کاتالیزور مرغوب کاتالیزوری است که انتخابی عمل کند.
غیر فعال شدن کاتالیزور
معمولا تمام کاتالیزورها دارای یک عمر معین هستند که پس از سپری شدن آن فعالیت موثر آنها کاهش مییابد که ممکن است بطور ناگهانی یا تدریجی باشد (افت فعالیت). در چنین مواقعی معمولا بسته به نوع و مکانیسم غیر فعال شدن ، باید کاتالیروز را بازیابی یا جایگزین کرد. در این مواقع باید تصمیم بگیریم که آن را تعویض یا احیا کنیم. تصمیم بر اساس مکانیسم های غیر فعال شدن است و مهمترین و متداولترین مکانیسم غیر فعال شدن عبارت است از:
- در کاتالیزورهای نفتی ، تجزیه هیدروکربنها در دمای بالا موجب تشکیل لایه ضخیمی از کربن غیر فعال روی سطوح کاتالیزور میگردد که همین دوره باعث میشود که روی سایت کاتالیزور پوشیده و از کار میافتد.
- پدیده دوم مربوط به مسموم شدن کاتالیزور میباشد. این پدیده زمانی اتفاق میافتد که ماده جذب شونده باعث تعییر آرایش کاتالیزور میشود. آرایش بلوری در فعالیت کاتالیزور نقش اساسی دارد. تغییر آرایش بلوری باعث غیر فعال شدن آن میشود. عواملی مانند سولفور این پدیده را ایجاد میکند.
- عامل سوم مربوط به وجود ناخالصیهای فلزی در سطح کاتالیزور میباشد. این ناخالصیها در مناطق فعال ، جذب و فعالیت کاتالیزور را کاهش میدهند.
- اورگانومتالیکهای فلزی معمولا به مقدار بسیار به عنوان کاتالیستها مورد استفاده قرار میگیرند. از تجزیه ناخواسته این کاتالیستها در دمای بالا اورگانومتالیکهای تیتانیم و وانادیم ایجاد شده، ضمن بلوکه کردن کانالهای کاتالیکی باعث کاهش فعالیت کاتالیزوری میشوند.
- معمولا ساختمان کاتالیزورها یک ساختمان متخلخل و پرزدار است. حفره های میکرونی در روی کاتالیزور وجود دارد که شوکهای حرارتی باعث مسدود شدن این میکرو پرزها میگردد. بنابراین شوکهای حراراتی ممکن است فعالیت کاتالیزورها را کاهش دهد.
بازیابی کاتالیزور
- کاتالیزور را میتوان با عبور هوای گرم احیا کرد.
- در مکانیسم های دیگر از وجود ناخالصیها که باعث مسموم شدن کاتالیزور می شود جلوگیری کرد.
طبقه بندی سیستم های کاتالیکی
عملکرد کاتالیزورها در دو فار هموژن و هتروژن انجام میگردد. فاز هموژن حالتی است که مواد واکنشدهنده و کاتالیزور در یک فاز قرار میگیرند. حال آنکه اگر عملکرد کاتالیزور و مواد واکنشدهنده در دو فاز مختلف باشد و مرز فیزیکی بین کاتالیزور و مواد واکنشدهنده وجود داشته باشد، چنین فازی را هتروژن میگویند.
کاتالیزورهای جامد
- جامد فلزی:
مناسب واکنشهایی هستند که مواد واکنشی از هیدروژن و یا هیدرو کربن تشکیل شدهاند. عمده کاتالیزورهای این دسته از عناصر واسطه تشکیل میگردد. مثل نقره ، پلاتین ، آهن و نیکل و پالادیم.
معمولا ویژگی این فلزات و کاتالیزورها به گونه ای است که هم هیدروژن و هم هیدروکربن به راحتی در سطح این کاتالیزورها جذب میگردند. این کاتالیزورها برای واکنشهای هیدروژن و هیدروژنگیری مناسب است و برای واکنشهای اکسیداسیون مناسب نیست، چون احتمال اکسید شدن خود فلزات هم وجود دارد. - کاتالیزورهای اکسید فلزی:
اکسید روی ، اکسید نیکل ، اکسید منگنز ، اکسید کروم ، اکسید بیسموت ، اکسید مولیبدن. ویژگی این کاتالیزورها در این است که میتوانند در واکنش ، اکسیژن مبادله کنند (یعنی میتوانند اکسیژن را دوباره به حالت اول برگردانند). - کاتالیزروهای اکسید فلزی _ عایق:
اکسید منیزیم ، اکسید آلومینیم ، سیلیس. این کاتالیزورها بعنوان جاذبه الرطوبه مورد استفاده قرار میگیرند. - کاتالیزورهای زیگلر _ ناتا:
در پلیمریزاسیون استفاده میشود. نسل جدیدی از کاتالیزورهای زیگلر _ ناتا در متالوسیون استفاده میشود.
عوامل موثر در فعالیت کاتالیزور
- سطح کاتالیزور
- قدرت و استحکام پیوند جذبی
راههای افزایش سطح کاتالیزور
- پودر کردن یعنی افزایش سطح کاتالیزور بطریق فیزیکی
- ایجاد خلل و فرج و کانالهای بسیار ظریف میکروسکوپی در بدنه کاتالیزور
- نشاندن کاتالیزور روی بستری از آلومینا و زئولیت
- متخلخل کردن کاتالیزور
کاربرد کاتالیزور
کاتالیزور در سه بخش به کار می رود:
- صنعت اتومبیل:
در این بخش کاتالیزورها بصورت مستقیم و غیرمستقیم استفاده میشوند. در اگزوز اتومبیلها بستری از فلزات جامد مثل پلاتین روی پایه آلومینات قرار گرفته و هیدروکربنهای مضر مثل منوکسید کربن و غیره را جذب میکند. - صنعت نفت و پالایش مواد نفتی:
عمده ترین مصرف کاتالیزورها در صنعت نفت در دو پروسه کراکینگ (شکستن مولکولهای درشت به کوچک) و رفرمینگ (دوباره باز آرائی و ترکیب مولکولهایی برای تولید) میباشد.
در صنعت نفت بیشتر کاتالیزورهای زیگلر _ ناتا، کاتالیزورهای فلزی و اورگانومتالیک مثل رودیوم استفاده میشود. - تولید مواد شیمیایی
کاتالیزور چیست؟
کاتالیزور ماده ای است که سرعت واکنش شیمیایی را افزایش می دهد. کاتالیزور در ابتدا با مواد اولیه تشکیل پیوند می دهد و آنها را به محصول تبدیل می کند. سپس محصول از سطح کاتالیزور جدا می شود و مواد واکنش نکرده برای ادامه واکنش روی سطح کاتالیزور باقی می مانند. در حقیقت، می توان واکنش های کاتالیزوری را به صورت یک سیکل بسته در نظر گرفت که در ابتدا کاتالیزور وارد واکنش می شود سپس در انتهای سیکل به شکل اولیه خود بازیابی می شود.
کاتالیزور به فرم های مختلفی وجود دارد، فرم های متنوع اتمی و مولکولی تا ساختار بزرگی نظیر زئولیت ها یا آنزیم ها در گستره کاتالیزور ها قرار می گیرند. علاوه براین آنها می توانند در محیط های مختلفی بکار بروند: در مایعات، گازها یادر سطح جامدات.
در یک نگاه کلی می توان کاتالیزور ها را به سه زیر مجموعه تقسیم کرد: کاتالیزور های همگن، کاتالیزورهای غیر همگن و کاتالیزور های حیاتی
کاتالیزور همگن
درکاتالیزور همگن ماده ای که به عنوان کاتالیزورکار میکند، با مواد واکنشدهنده در یک فاز گاز یا مایع باشند. واکنش های صنعتی مانند Hydroformylation و پلیمریزاسیون اولفین ها از کاتالیزور های همگن استفاده می کنند. یکی از واکنش هایی که در یک فاز انجام می شود، سنتز اسید استیک از متانول و مونوکسید کربن با استفاده از یک کمپلکس RH می باشد.
کاتالیزور ناهمگن
هنگامی که یک مرز مشترک فازی، کاتالیزور را از مواد واکنش دهنده جدا سازد، آنگاه کاتالیزور را ناهمگن می نامند. کاتالیزور ناهمگن عمدتاً از طریقجذب سطحیشیمیاییمواد واکنش دهنده روی سطح کاتالیزور صورت میگیرد.
کاتالیزور های حیاتی
بسیاری ازفرایندهای صنعتیبه اعمالی بستگی دارند که با کاتالیزور صورتمیگیرند. ولی کاتالیزورهایی که برای انسان مورد اهمیت بیشتری دارند، کاتالیزورهایطبیعی یعنی آنزیمها هستند. این مواد فوق العاده پیچیده، پروتئین های بزرگی هستند که فرایندهای حیاتی مانندگوارشو سنتز سلولی را کاتالیز میکنند.
اجزاء مهم کاتالیزور
کاتالیزور ها می توانند بصورت اکسیدها، نیتریدها، اسیدها، نمک ها، بکار بروند. تهیه و آماده سازی کاتالیزور ها ترکیبی از علم و هنر است اما اساس آن بر مبنا ی آزمایش می باشد. کاتالیزور ها بر حسب نوع فرایندی که در آنها مورد استفاده قرار می گیرند به شکل ها و اندازه های متفاوتی (میکروسکوپیک، مزوسکوپیک و ماکروسکوپیک ساخته می شوند.
کاتالیزور های صنعتی به ندرت از یک ترکیب درست شده اند، اما معمولاً از دو جزء و یا بیشتر و به ندرت از اجزای بسیار زیاد تشکیل می شوند. در هر کاتالیزور مورد استفاده در صنایع مختلف، علاوه بر فاز فعال ترکیبات دیگری به منظور تغییر در خصوصیات کاتالیزور از قبیل فعالیت، گزینش پذیری، پایداری و غیره استفاده می شود.
کاتالیزور های جامد از سه جزء اصلی تشکیل شده اند:
·فاز فعال
·پروموتر
·پایه
مثلاً در کاتالیزور CuO/ZnO/Al2O3، که کاتالیزور سنتز متانول از گاز سنتز می باشد، CuO جزء فعال کاتالیزور ZnO پروموتر و Al2O3 نقش پایه کاتالیزور می باشد.
فاز فعال
انتخاب فاز فلز در تهیه کاتالیزور مورد نظر نقش بسیار مهمی دارد. فلز بایستی طوری انتخاب شود که واکنش های مورد نظر را به طور کامل انجام داده و قادر به انجام واکنش های ناخواسته نباشد. فاکتورهای مهم در انتخاب فاز فعال عبارتند از:
·فعالیت
·گزینش پذیری
·پایداری حرارتی و مکانیکی
·قابلیت باز یابی
·قیمت
·اندازه و شکل ذرات
پروموتر یا ارتقادهنده
پروموتر به موادی گفته می شود که به مقدار خیلی کم به کاتالیزور افزوده می گردد، تا فعالیت بهتر، گزینش پذیری یا پایداری بیشتری را در آن ایجاد کند این ترکیبات به دوصورت فلزی و اکسیدی در ساختار کاتالیزور می توانند وجود داشته باشند. مکانیسم عمل پروموتر ها به این صورت است که تقویت کننده ها با ایجاد نقص هایا بینظمی های شبکه در سطح کاتالیزورکه باعث ناهمواری های سطحی (پله ها) می شود، نقش عمده ای در کنترل فعالیت و گزینش پذیری کاتالیزور دارند.
اغلب پروموتر ها را می توان به پروموتر های الیاف جلوگیری از جمع شدن و انباشتگی بلورهای فعال کاتالیزور) و پروموتر های ساختاری (اثرات شیمیایی و الکترونی بر روی ساختار کاتالیزور) تقسیم بندی نمود. یک تقویت کننده الیافی (پایدارکننده) اثرات فیزیکی دارد اما یک تقویت کننده ساختاری (الکترونی) اثرات شیمیایی به سیستم تحمیل می نماید.
اصطلاح پایه به موادی اطلاق می شود که قسمت بدنه کاتالیزور را تشکیل می دهند و جزء فعال کاتالیزور و تقویت کننده ها روی آن قرار می گیرند. پایه کاتالیزور در اغلب موارد اصلاً فعالیت کاتالیزوری ندارد. اولین خاصیتی که یک پایه کاتالیزور باید داشته باشد، خنثی بودن آن از نظر شیمیایی است.
پایه کاتالیزور باعث توزیع و پخش شدن کاتالیزورهای گران قیمت مانند پلاتین می گردد. در اصل پایه برای بهینه کردن بافت لازم کاتالیزور یا برای تقویت تشکیل یک فاز فعال ویژه انتخاب می گردد. پایه به کاتالیزور مقاومت مکانیکی و حرارتی لازم را می دهد و آن را در مقابل خرد شدن و کلوخه شدن محافظت می کند. برای این که بتوان کاتالیزور های ناهمگن را در اشل صنعتی مصرف کرد باید کاتالیزور در شرایط واکنش واکنش فعالیت، گزینش پذیری و بالایی داشته باشد. به این منظور در اغلب فرایند های کاتالیزوری برای رسیدن به کاتالیزوری با مساحت سطح ویژه بالا و حداکثر فعالیت ویژه، فاز فعال فلزی بر روی پایه پراکنده می شود.
فسفرسانس و فلوئورسانس
فسفرسانس و فلوئورسانس پدیده هایی هستند که در آنها یک ماده خاص که بطور عام به آن فسفر گفته میشود پس از قرار گرفتن در مقابل نور مرئی یا غیر مرئی یا حرارت ( تحریک شده ) این انرژی را در خود ذخیره می کند و سپس آن انرژی را بصورت طیفی از امواج مرئی در طول مدت زمانی منتشر می کند .
اگر این بعنوان شباهت این دو پدیده باشد. تفاوت آنها در اختلاف زمانی بین این دو دریافت و تابش یا به عبارت گر دوام تابش است . اگر زمان تحریک کمتر از ۱۰ به توان ۸- ثانیه باشد، این پدیده را Fluorescent می نامیم و اگر زمان تحریک بیش از ۱۰ به توان ۸- ثانیه باشد آن را Phosphorescent می نامیم.به عبارتی در فسفرسنس تحریک طولانی تر و تشعشع طولانی تری..........
داریم و در فلوئورسانس تحریک کوتاهتر تر و تشعشع کوتاهتری تری داریم.در فلوئورسانس که نمونه آن نور مهتابی یا صفحه تلویزیون است تابش آنی است و تقریبا" بلافاصله بعد از قطع نور تمام میشود . در حالی که در فسفرسانس ماده بعد از قطع نور نیز تا مدتی به تابش ادامه میدهد که مقدار آن بسته به ماده مورد استفاده می تواند از چند ثانیه تا چندین روز طول بکشد . در فلوئورسانس برانگیختگی میان دو تراز اصلی با انرژی های E1,E2 اتفاق می افتد که جابجایی بین أنها کاملا" أزاد است .الکترون با دریافت انرژی بر انگیخته شده وبه تراز E2 می رود وپس از 8تا 10 ثانیه دوباره به تراز اول بر می گردد و فتونی با انرژی E2-E1 تابش می کند اما در فسفرسانس ماجرابدلیل وجود یک تراز میانی کمی پیچیده تر است این تراز که مابین تراز پایه و برانگیخته قرار دارد تراز نیمه پایدار می باشد و مانند یک دام برای الکترونها عمل میکند به خاطر شرایط خاص این تراز انتقال الکترون از أن به سایر ترازها ممنوع واحتمال أن بسیار کم است بنابراین چنانچه الکترونی پس از برانگیختگی از تراز E2 در دام تراز نیمه پایدار بیافتد انجا می ماند تا زمانی که به طریقی دیگر مجددا" برانگیخته شود وبه تراز E2 برگردداین اتفاق می تواند تحت تاثیر جنبشهای گرمایی اتمها یا مولکولهای مجاور ویا برانگیختگی نوری روی دهد اما احتمال وقوع أن بسیار کم است به همین دلیل چنین الکترونهایی تا مدتها در تراز میانی می مانند (بسته به ساختار اتمی ماده و شرایط محیطی) وهمین عامل تاخیر در باز تابش بخشی از انرژی دریافت شده است.تحریک این ماده ها به گونه های مختلف انجام می شوند: بمباران فوتونی، الکترونها، یونهای مثبت، واکنشهای شیمیایی، گرما و گاهی اوقات ( مخصوصاً در جانداران ) تنش های مکانیکی... راز کرمهای شب تاب در فسفرسانس است.
برای ساختن مواد درخشنده در تاریکی باید فسفری وجود داشته باشد که با استفاده از نور معمولی انرژی بگیرد و طول تابش ان زیاد باشد.برای مثال دو فسفری که این ویژگی ها را دارند مثل ( Zinc Sulfide ) و ( Strontium Aluminate ). که ( Strontium Aluminate ) بهتر است برای طول تابش بیشتر.
این مواد با پلاستیک مخلوط میکنند و مواد درخشنده در تاریکی را میسازند.
بعضی مواقع ممکن است شما موادی را ببینید که میدرخشند ولی به انرژی احتیاجی ندارند!یکی از ان مثالها بروی عقربه های ساعتهای گران قیمت است.درانها فسفر با یک عنصر رادیو اکتیو مخلوط شده (مثل رادیوم- radium) که ان عنصر با انتشار رادیو اکتیو فسفر را مرتبا با انرژی میکند.
لامپ های فلوئورسنت :
ادامه مطلب ...مختصری از کاربردهایHF
بعضی از محققین امکان استفاده از گاز فلوئور خالص را بهعنوان سوخت موشک بررسی کردهاند، چون این گاز دارای ضربه مخصوص بالائی میباشد.
- در تولید آلومینیوم فلورید(AlF3) که برای ساخت کریولیت بکار می رود.
- بعنوان رسوبزدا در اسیدشویی فولاد ضد زنگ.
در فرآیندهای زیادی فلوئورید هیدروژن مورد استفاده میگیرد که در ادامه به تعدادی از آنها اشاره شده است.
- سنتز آمونیوم بی فلوراید از واکنش آمونیاک و هیدروژن فلوئورید.
- ساخت پلی تترا فلوئورو اتیلن از پلیمریزاسیون تترا فلوئورومتان،که از اسید کلریدریک گیری مونو کلرو دی فلوئورومتان تولید می شود وخود آن نیز از ترکیب کلروفرم و اسید فلوئوریدریک بدست می آید.
- برای حکاکی روی شیشه در لامپ و محصولات دیگر بکار میرود.
در تولید کریستال های تزئینی و مات کاری شیشه آلات ،مقررات محیط زیست در بسیاری از کشورها ایجاب می کند، میزان پخش فلوریدها در هر متر مکعب از هوای خروجی واحدهای صنعتی نبایستی بیشتر از 5 میلی گرم باشد.
ادامه مطلب ...نمونه برداری ازجامدات, مایعات وگازها
روشهای نمونهبرداری از گازها
سلنیم و کاربردهای آن
اطلاعات اولیه
سلنیوم یک عنصر شیمیایی جدول تناوبی است که نماد آن Se و عدد اتمی آن 34 میباشد. این عنصر یک نافلز سمی بوده که از نظر شیمیایی به گوگرد و تلوریم شباهت دارد. این عنصر در شکلهای گوناگون وجود دارد، ولی بیشتر به شکل شبه فلز که هادی جریان الکتریسیته میباشد، بوده ، در سلولهای نوری کاربرد دارد. این عنصر در معادن سولفید مانند پیریت یافت میشود.
تاریخچه
سلنیوم که لاتین آن Selene به معنی ماه میباشد، در سال 1817 توسط "Jons Jacob Berzelius" که ارتباط این عنصر با تلوریوم را دریافت، کشف شد. کاربردهای گسترده این عنصر از قبیل استفاده آن در ترکیبات لاستیکی آلیاز فولاد و یکسو کنندههای سلنیومی باعث رشد چشمگیری در مصرف این عنصر شد. در سال 1970 سلنیوم جایگزین سیلیکن در یکسو کنندههای برق شد، اما کاربرد گسترده آن بهعنوان رسانای نور در کاغذ کپی مهمترین استفاده آن بود.
در طی دهه 1980 با تولید رساناهای نور آلی ، استفاده از سلنیوم به عنوان رسانای نور منسوخ شد. در سال 1996 رابطه مثبتی در خصوص مصرف سلنیوم و خاصیت ضد سرطان آن کشف شد، اما کاربرد گسترده و مستقیم این کشف بزرگ نمیتوانست بهصورت قابل توجهی تقاضای آن را در دوز های مصرفی کوچک بکند. در اواخر دهه 1990 کاربرد سلنیوم (معمولا با بیسموت) بهعنوان یک ماده اضافه کننده در لوله کشی برنجی برای داشتن یک محیط بدون سرب افزایش یافت.
پیدایش
سلنیوم بهصورت سلنید از کانیهای سولفیدی مانند مس ، نقره و سرب بدست میآید. این عنصر از گل و لای آنودی مس و گل و لای سربی حاصل از گیاهان اسید سولفوریک بهصورت یک محصول جانبی بدست میآید.
خصوصیات قابل توجه
ادامه مطلب ...