شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.شیمی - بازرسی فنی
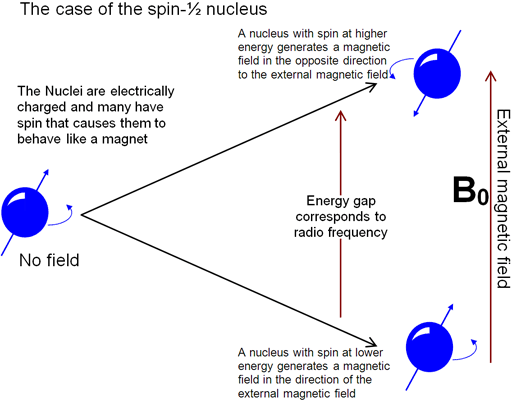
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.طیف سنجیNMR چیست؟
Uses of NMR spectroscopy
Nuclear Magnetic Resonance (NMR) spectroscopy is an analytical chemistry technique used in quality control and reserach for determining the content and purity of a sample as well as its molecular structure. For example, NMR can quantitatively analyze mixtures containing known compounds. For unknown compounds, NMR can either be used to match against spectral libraries or to infer the basic structure directly. Once the basic structure is known, NMR can be used to determine molecular conformation in solution as well as studying physical properties at the molecular level such as conformational exchange, phase changes, solubility, and diffusion. In order to achieve the desired results, a variety of NMR techniques are available. The basics of NMR are described here
اسپکتروسکوپی مادون قرمز Infra red ) IR )
اسپکتروسکوپی مادون قرمز Infra red ) IR )
مشاهده پیک در IR در اثر تغییر در سطوح انرژی ارتعاشی مولکول می باشد که بطور عمده شامل ارتعاشات کششی stretching و خمشی bending می باشد.محدوده جذب معمولی IR ( 2.5 تا 25 میکرومتر ) و یا برحسب عدد موج 400 تا 4000 cm -1 می باشد.موقعیت پیکها در IR بستگی به ماهیت پیوند ها دارد. پیکهای واقع در انتهای طیف ، دارای انرژی بالاتر ( طول موج کوتاهتر ) می باشند و اغلب مربوط به ارتعاشات کششی پیوند های کوتاه و قوی می باشند.استفاده از عدد موج در مقایسه با طول موج، جهت بیان محلهای جذب از این نظر که عدد موج با انرژی نسبت مستقیم دارد و همچنین جهت بیان محلهای جذب که از اعداد اعشاری استفاده نمی شود، ارجحیت دارد.
اجزاء و قسمتهای مختلف دستگاه اسپکتروسکوپ
منبع نور :
معمولا لامپ نرنست ( Nernst ) است که شامل میله ای است که مخلوط اکسید زیرکونیوم ( Zirconium ) ، ایتریوم( Yttrium ) و اربیوم ( Erbium ) می باشد و به کمک برق تا oC 1500 ۫گرم می شود .
محل نمونه :
چون شیشه و کوارتز تقریبا همه طول موجهای ناحیه مادون قرمز را جذب می کنند ، از این رو نمی توانند به عنوان سل و یا به عنوان منشور دستگاه IR بکار روند. نمک های هالوژنه به این منظور بکار میروند و معمولا از کلرور سدیم به عنوان سل نمونه استفاده می شود ، که چون در آب حل می گردد ، اگر نمونه حاوی آب باشد ، از سل AgCl و یا برخی از پلیمرها استفاده می گردد.
منو کروماتور :
باید از جنس نمکهای هالوژنه باشد.
دتکتور :
از نوع حرارتی و ترموکوپل است . میزان انرژی نورانی جذب شده متناسب با میزان حرارت ایجاد شده می باشد .
رکوردر ( ثبات ) :
طیف نمونه را رسم می کند.
کاربرد طیف IR
ادامه مطلب ...نیمه عمر چیست
تجزیه رادیواکتیو: به طور تجربی معلوم شده است که برای گروه بزرگی از اتمهای یک نوع ماده رادیواکتیوی کسری از این اتمها که در هر ثانیه دچار تباهی میشوند، تعییرناپذیر است و همیشه برای گروه بزرگی از اتمهای آن نوع ماده رادیواکتیو ، یکسان است. این کسر تقریبا به طور کمی مستقل از تمام شرایط فیزیکی و شیمیایی ، مثلا دما ، فشار و شکل ترکیب شیمیایی است. این خواص برجسته رادیواکتیویته شایان توجه خاصی است. زیرا پایهای برای فهم رادیواکتیویته است. مثلا فرض کنید که ۱۰۰۰/۱ اتمهای یک نمونه خالص تازه تهیه شده در طول یک ثانیه تباهیده شوند. در این صورت انتظار خواهیم داشت که ۱۰۰۰/۱ اتمهای باقیمانده در یک ثانیه بعد دچار تباهی شوند. به این ترتیب ۱۰۰۰/۱ اتمهای باقیمانده پس از ده ثانیه نیز در طول ثانیه یازدهم تباهیده میشوند و همین طور تا آخر.
● نیم عمر چیست؟ واقع امر این است که در طول هر ثانیه متوالی از زمان ۱۰۰۰/۱ اتمهای باقیمانده در آغاز آن ثانیه دچار تباهی میشود. این عمل دست کم تا آنجا ادامه دارد که تعداد اتمهای باقیمانده به قدری کوچک شوند که پیشگویی های ما بسیار نامطمئن باشد. چون کسری از اتمها که در هر ثانیه نابود میشود، برای هر عنصر ثابت است. عده اتمهایی که در واحد زمان دچار تباهی میشوند به نسبت کاهش عده اتمهایی که هنوز تغییر نیافتهاند، تقلیل مییابد. برای اورانیوم ۲۳۸ که مادر سری اورانیوم است، نیم عمر ، ۴.۵ بیلیون سال است. این بدان معنی است که پس از ۴.۵x۱۰۹ سال ، نصف اتمهای اورانیوم ۲۳۸ دچار تباهی میشوند. برای پلونیوم ۲۱۴ ، نیم عمر از مرتبه ۱۰-۴ ثانیه است. یعنی فقط در ۱۰۰۰۰/۱ ثانیه ، نصف یک نمونه اصلی از اتمها ۲۱۴Po میشوند. هرگاه نمونههای خالصی شامل عده اتمهای برابر ، از هر یک از آنها موجود باشد، فعالیت اولیه (اتمهایی که در ثانیه دچار تباهی میشوند) پولونیم ۲۱۴ بسیار قوی و فعالیت اولیه اورانیوم ۲۳۸ بسیار ضعیف خواهد بود. لیکن اگر حتی یک دقیقه بگذرد پولونیم کلا نابود میشود و بنابراین ، عده اتمهای باقیمانده آن به قدری کم میشود که در این حالت فعالیت پولونیم کمتر از فعالیت اورانیوم خواهد بود.
● محاسبه نیم عمر: شاید مدتها پیش عناصر رادیواکتیو به مقدار زیاد وجود داشته و چنان به سرعت نابود شدهاند که امروز هیچ اثر قابل اندازهگیری از آن به جا نمانده است. از طرف دیگر بسیاری عناصر رادیو اکتیو چنان به کندی نابود میشوند که در حین هر بار آزمایش عادی ، سرعتهای شمارش که تباهی را نشان میدهد، به نظر ثابت میماند. برای هر عنصر با نیم عمر T½ ، صرف نظر از کهنگی نمونه ، پس از گذشت فاصله زمانی T½ بازهم نصف اتمهای آن باقی خواهد ماند. بنابراین ، نیم عمر را نباید به عنوان علامت اختصاری برای "نصف یک عمر" تصور کرد. اگر نصف اتمهای اصلی پس از زمان T½ بدون تغییر باقی بماند، پس از دو فاصله زمانی نیم عمر متوالی T½ ، یک چهارم (½× ½) ، و پس از T ½۳ ، یک هشتم اتمها و همچنین تا آخر باقی خواهد ماند.
مرجع:http://www.iaushimi.blogfa.com/
تجزیه عنصری
تجزیه عنصری

برای اکسیژن آزمایش ساده ای وجود نداردو عناصر دیگر با پیوند کوالانسی در اتصال هستندو بنابراین با آزمایش های یونی معمولی مستقیما جواب نمی دهند.ولی اگر جسم آلی مجهول با سدیم مذاب ذوب شود در اگثر موارد طوری ترکیب می شود که NوSوXآن به یونهای CNوSوCNSوXتبدیل می شود.پس از آنکه سدیم اضافی دقیقا از بین برده شد محلول آبی را که محتوی این یونهاست به روش معمولی معدنی تجزیه می کنند.توضیح کامل تری در این مورد وجود دارد که در زیر به آن می پردازیم.
کربن هیدروژن واکسیژن
برای اثبات وجود کربن و هیدروژن نمونه رابا پودر خشک مس(II) اکسید حرارت داده که منجر به ایجاد کربن دی اکسید وآب می شود . حضور کربن در نمونه با عبور دادن گاز های ایجاد شده از درون محلول با ریم یا کلسیم هیدروکسید مشخص نمی شود که دراین صورت رسوب کربنات مربوطه حاصل می شود . هیدروژن را می توان با ایجاد قطره های آب متراکم شده روی قسمت بالایی لوله تشخیص داد . هیچ آزمایش کیفی برای اثبات وجود اکسیژن در ترکیبات آلی وجود ندارد برای تعیین اکسیژن باید تجزیه کمی صورت بگیرد .دراین روش اگر اگر مجموع درصد تمام عناصر تشکیل دهنده ترکیب کمتر آن تا 100 مربوط به در صداکسیژن است .
نیتروژن گوگرد و هالوژن ها
Sustainable Electrodes for Solar Cells

Sustainable Electrodes for Solar Cells
To generate solar energy, a solar cell must have an electrode that is transparent. Currently there are two materials which meet this requirement: indium tin oxide (ITO), which is the preferred one, and fluorine tin oxide (FTO), which is less effective. However, indium is rare and has to be extracted from zinc and lead ores, of which it is a minor component; production is less than 500 tons a year.
ITO and FTO are not without their drawbacks. They lack transparency with respect to the infrared region of the spectrum, and this restricts their ability to gather a wider range of solar energy. They are unstable in the presence of acids and bases, and their metal ions are prone to diffusing into the polymer layers thereby reducing efficiency. Unless they are structurally perfect they suffer from current leakage
ادامه مطلب ...ایزومرها در شیمی فضایی
یک بخش از شیمی فضایی ، ایزومری فضایی است. ایزومرها ترکیبات متفاوتی هستند که فرمول مولکولی یکسانی دارند. ایزومرهای خاصی که فقط از نظر جهت گیری اتمها در فضا باهم تفاوت دارند اما از نظر نحوه اتصال اتمها به یکدیگر ، شبیه یکدیگرند، ایزومرهای فضایی نام دارند.
شباهت و تفاوت ایزومرهای فضایی
تفاوت جفت ایزومرهای فضایی از نظر ساختار و بنابراین از نظر خواص بسیار کوچک است. اما از نظر همه خواص فیزیکی قابل سنجش ، با یکدیگر مشابهند مگر از نظر تاثیر بر نوعی نور غیر عادی. با استفاده از همین تاثیر متفاوت و دستگاه خاص مربوطه میتوان دو ایزومر را از یکدیگر باز شناخت.
کاربرد متفاوت ایزومرهای فضایی
با وجود شباهت نزدیک ، وجود اینگونه ایزومرها ، یکی از سنجشگرهای بسیار حساس را برای تشخیص مکانیسم واکنشها در اختیار شیمیدان میگذارد. غالبا یکی از این ایزومرها برای مطالعه برگزیده میشود. نه به این دلیل که این ایزومرها از نظر شیمی سه بعدیاش با ترکیبهای دیگر فرق دارد، بلکه به این دلیل که این ترکیب میتواند نکتههایی را آشکار سازد که در ترکیبهای عادی پنهاناند و باز هم با وجود شباهت نزدیک دو ایزومر فضایی ، ممکن است یکی از آنها یک غذای مقوی یا یک آنتی بیوتیک یا یک داروی محرک قلب باشد، ولی ایزومر دیگر ترکیبی بیمصرف باشد.
تعداد ایزورمها و کربن چهار وجهی
باید در نظر داشت که هر ترکیبی ولو پیچیده که دارای کربنی متصل به چهار اتم دیگر است را میتوان مشتقی از متان تلقی کرد و آنچه که درباره شکل مولکول متان فرا میگیریم را میتوانیم درباره شکل مولکولهای پیچیده بکار بریم. برای هر اتم ، فقط یک ماده با فرمول یافت شده است. با کلردار کردن متان ، فقط یک ترکیب با فرمول و با برمدار کردن آن فقط یک ترکیب با فرمول بدست میآید. به همین ترتیب فقط یک و یک شناخته شده است.
در واقع ، اگر ، بجای اتم نمایاننده یک گروه از اتمها باشد نیز مطلب فوق صادق است، مگر هنگامی که گروه تا آن حد پیچیده است که خود سبب ایزومری میشود. به عنوان مثال فقط یک ، یک و یک وجود دارد. این نشان میدهد که در متان ، همه اتمهای هیدروژن هم ارزند، بطوری که با جایگزین کردن هر کدام از آنها ، فرآورده یکسانی حاصل میشود. اگر اتمهای هیدروژن متان هم ارز نبودند، با جایگزین کردن هر کدام از آنها ترکیب متفاوتی بدست میآمد و فرآوردههای استخلافی ایزومری حاصل میشدند.
برای اتمهای هیدروژن در متان سه آرایش امکان پذیر است که هم ارز باشند:
آرایش مسطح که در آن اتم کربن در مرکز یک مستطیل یا مربع و اتمهای هیدروژن در چهار گوشه آن قرار دارند.
آرایش هرمی که در آن اتم کربن در راس هرم و اتمهای هیدروژن در چهار گوشه آن قرار دارند.
آرایش چهار وجهی که در آن کربن در مرکز چهار وجهی و هر اتم هیدروژن در یک گوشه آن است.
فعالیت نوری
نور خواصی دارد که با در نظر گرفتن آن به عنوان یک پدیده موجی بخوبی درک میشوند. موجی که در آن ارتعاشها بصورت عمود بر جهت حرکت نور روی میدهند. تعداد سطحهایی که از خط مسیر نور میگذرند بیشمارند و نور معمولی در همه این سطوح در حال ارتعاش است. اگر مستقیما به باریکهای از نور یک لامپ بنگریم، نوع ارتعاشهایی که روی میدهند و همگی عمود بر خط بین چشمان ما و منبع نور (لامپ) هستند را نشان میدهد.
نور معمولی ، با عبور کردن از یک عدسی ساخته شده از مادهای به نام "پلاروید" یا از یک قطعه کلسیت (نوعی بلور ) با آرایشی که به نام منشور نیکول معروف است، به نور قطبیده در سطح تبدیل میشود. یک ماده فعال نوری ، مادهای است که سطح نور قطبیده را میچرخاند. وقتی نور قطبیده در حال ارتعاش در یک سطح معین ، از میان یک ماده فعال نوری میگذرد، در حال ارتعاش در یک سطح دیگر پدیدار میشود.
پلاریمتر
الکترونگاتیویته چیست ؟
متداولترین مقیاس الکترونگاتیویته
مقیاس نسبی الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی б+ و б- اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق б و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد. در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد 4 نسبت داده شده است.
مقیاس الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوند است. مثلا انرژی پیوند Br-Br ، انرژی لازم برای تفکیک مولکول Br2 به اتمهای Br است. برای تفکیک یک مول از مولکولهای Br2 به اندازه 46+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر 104+ کیلو کالری بر مول است.
تعاریف مختلف الکترونگاتیویته
الکترونگاتیویته ، در روشهای متفاوتی تعریف شده است که برخی از آنها به اختصار توضیح داده میشود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B میتواند به حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B بطور قابل ملاحظه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد، میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد.
الکترونگاتیویته آلرد_روکر در این تعریف ، الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس میکند. بر طبق این تعریف ، عناصری با الکترونگاتیویته بالا آنهایی هستند که با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک ، این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توزیع دوباره الکترون در طی تشکیل تر کیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
اگر یک اتم دارای انرژی یونیزاسیون بالا و الکترونخواهی بالا باشد، احتمالا در هنگام تشکیل پیوند ، الکترونها را به سوی خود میکشد. بنابراین بعنوان الکترونگاتیو شناخته میشود. از طرف دیگر اگر انرژی یونش و الکترونخواهی آن ، هر دو کوچک باشد تمایل دارد تا الکترون از دست بدهد. بنابراین به عنوان الکترو پوزیتیو طبقه بندی میشود.
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی میکند.
تغییرات الکترونگاتیویته عناصر
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و همچنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد. فلزات ، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آنها حاکم است، ولی نافلزات ، به استثنای گازهای نجیب ، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آنها زیاد است.
بطور کلی ، الکترونگاتیوی عناصر در هر دوره از چپ به راست (با افزایش تعداد الکترونهای والانس) و در هر گروه از پایین به بالا (با کاهش اندازه اتم) افزایش مییابد. بنابراین ، الکترونگاتیوترین عناصر ، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات ، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی همجهت است.
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است، ولی دقیق نیست. روشی ساده و مستقم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روشهای گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتمهای متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم نامتغیر نیست.
انتظار میرود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از اینرو ، این مفهوم را تنها بایستی نیمهکمی تلقی کرد. بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی میشود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آنها خیلی زیاد نباشد. در اینگونه موارد، اختلاف الکترونگاتیوی عناصر نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است. اگر اختلاف الکترونگاتیوی صفر یا خیلی کوچک باشد، میتوان گفت که پیوند اساسا غیر قطبی است و اتمهای مربوط ، سهم مساوی یا تقریبا مساوی در الکترونهای پیوند دارند.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که HF قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل میشود، پیوند فلزی و در آن اختلاف الکترونگاتیوی نسبتا کم است.
کاربردهای الکترونگاتیویته
میتوان برای تعیین میزان واکنش پذیری فلزات و غیر فلزات بکار برد.
میتوان برای پیشبینی خصلت پیوندهای یک ترکیب بکار برد. هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود 1.7 باشد، خصلت یونی نسبی پیوند بیش از 50% است.
اگر اختلاف الکترونگاتیوی صفر و یا خیلی کوچک باشد، پیوند غیر قطبی است. هرچه اختلاف الکترونگاتیوی بیشتر باشد، پیوند کووالانسی قطبیتر خواهد بود. در این پیوندها ، اتمی که الکترونگاتیوی بیشتری دارد، بار منفی جزئی را خواهد داشت.
با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونی حاصل میشود. مثلا اختلاف الکترونگاتیوی سدیم و کلر 2.1 است و NaCl یک ترکیب یونی است.
آیا الکترونگاتیوی یک عنصر همیشه ثابت است؟
مفهوم الکترونگاتیوی غیر دقیق است. زیرا این خاصیت نه تنها به ساختمان اتم مورد بحث بستگی دارد، بلکه تعداد و ماهیت اتمهای دیگری که به اتم مزبور پیوند داده شدهاند نیز در آن دخالت دارد. بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
الکل Alcohol
الکل Alcohol

در شیمی به هر ترکیب شیمیایی که یک گروهِ هیدروکسیل (-OH) متصل به کربن یک آلکیل داشتهباشد، الکل گویند. فرمول کلی یک الکل سادهٔ عیر حلقهای CnH2n+1است. در شیمی الکلها در شمار گروه مهمی از ترکیبهای شیمیایی هستند و در واکنشهای گستردهای شرکت میکنند و بسیاری از ترکیبهای شیمیایی از آنها به دست میآیند، به طوری در کتاب شیمی آلی موریسن و بوید آمدهاست که اگر به شیمیدانی بگویند او را با ده ترکیب شیمیایی دریک جزیره تنها خواهند گذاشت الکل یکی از آنها خواهدبود.
به طور کلی، زمانی که نام الکل به تنهایی به کار میرود، معمولاً منظور اتانول است که همان الکل گرفتهشده از جو یا عرق یا همان مشروبات الکلی میباشد. اتانول مایعی بیرنگ و فرار وبا بویی بسیار تند است که از تخمیر شکرها به دست میآید. همچنین گاه به هر گونه نوشیدنی که الکل داشتهباشد، الکل میگویند. هزاران سال است که معمولاً الکل به عنوان یکی از عاملهای اعتیادآور به شمار میآید.
الکلهای دیگر بیشتر با صفتهای مشخصکنندهٔ ویژهٔ خود میآیند مانند الکل چوب (که همان متانول است) یا ایزوپروپیل الکل. پسوند «ول» نیز در پایان نام شیمیایی همهٔ الکلها میآید
تاریخچه
الکل را نخستین بار ابوبکر محمد بن زکریای رازی پزشک و شیمیدان ایرانی از تقطیر شراب تهیه کرد.[۱] وی آنرا الکحل نامید. بعدها یک آمریکایی بنام دکتر واندیک آن را الکل نامید. گرچه تاریخ تهیه شراب در به هزاران سال پیش در ایران نیز میرسد اما تا زمان رازی کسی الکل را خالص نکرده بود
ریشهشناسی
نظریهٔ غالب بر این است که از آنجا که نخستین بار که زکریای رازی الکل را کشف کرد، آن را با نامِ تازیِ «الکحل» خواند و از آنجا آن را اعراب «الکحول» نامیده و سرانجام در فارسی الکل نام گرفت ولی از آنجا که در عربی «الکحول» نمیتواند از «الکحل» مشتق شدهباشد این احتمال وجود دارد که این واژه از واژهٔ «الغول» که در قرآن آمدهاست گرفته شدهباشد و ریشهای اروپایی داشته باشد.[۲]
ساختار و دستهبندی
الکلها بسته به نوع کربن[۳] که به گروه OH- پیوند دارد، به سه دسته نوع اول ، نوع دوم یا نوع سوم طبقهبندی میشوند:

الکل نوع اول CR(H)۲-OH.
الکل نوع دوم C(R)۲H-OH.
الکل نوع سومC(R)۳-OH.
خواص فیزیکی الکلها
دمای جوش
زغال فعال شده چیست؟
زغال فعال شده چیست؟
اصطلاح زغال فعال شده نشان دهنده یک سری از مواد جذب کننده سطحی , با جنسی زغالی و شکل کریستالی می باشد که در ساختار داخلی آن روزنه های زیادی وجود دارد.
زغال فعال شده دارای کاربردهای زیادی است, از جمله مصارف آن:
- تصفیه آبها ( آب شرب, آب آکواریومها, آبهای صنعتی), از نظر رنگ و بو و طعم
- رنگزدایی از قند و شکر
- بازیافت طلا
- بهسازی رنگ و طعم در نوشیدنی ها و آب میوه ها
- استفاده در دستگاههایی مثل: تصفیه کننده های هوا, خوش بو کننده ها, تصفیه کننده های صنعتی و ...
- ....
تولید زغال فعال شده اصول و فنون گوناگونی در ساخت و تولید زغالهای فعال شده وجود دارد که به 3 اصل بستگی دارد:
- نوع ماده اولیه
- مشخصات فیزیکی مورد نظر برای محصول (زغال فعال شده)
- مشخصات جذبی برای کاربردهای مختلف
شیوه های فعالسازی که بیشتر در تولیدات تجاری بکار میرود عبارتند از:
فعال سازی شیمیایی،فعال سازی توسط بخار
فعال سازی شیمیایی:
ادامه مطلب ...فتوکاتالیست چیست؟
فتو کاتلیست چیست؟ فتو کاتالیست ها مواد پاک کننده محیطی هستند ،هنگامی که نورخورشید و یا فلورسانس به آنها برخورد می کند ازروی سطوح آلودگی ها را بر می دارند و می توانند ترکیبات آلی مثل باسیل ها و بو ها را از بین ببرند. فرایند فتو کاتالیستی از اصول زیر پیروی می کنند.
اصول فرایندفتو کاتالیستی:
1.در معرض اشعه ماورای بنفش UV در زمانی که نور اشعه UV به فتو کاتالیست بر خورد می کند ، الکترون به سطح بالا می آید.در این زمان حفره ای که الکترون از آن بیرون جهیده بود حفره مثبت نامیده می شود . 2.ظهور رادیکال های OHحفره مثبت دارای قدرت اکسیداسیون بالایی است و الکترون را از-OH (یون هیدروکسید )در آب می گیرد.در این زمان- OH،که الکترونش گرفته شده تبدیل به OH رادیکالی می شود که تا حد زیادی ناپایدار است. 3.تخریب ترکیبات آلی OH رادیکالی ،طی یک اکسیداسیون قوی الکترون را از نزدیک ترین ترکیب آلی همسایه دریافت می کند تا به پایداری بیشتری برسد.با این روش ترکیبات آلی با از دست دادن الکترون ودر نهایت تبدیل شدن به دی اکسید کربن و آب تخریب می شود و به اتمسفر بر می گردد. 1.سوال؟>>فتو کاتالیست ها با منبع نور کار می کنند.چه نیازی هست که منبع نور حتما مااورای بنفش باشد؟ TiO2 یک نیمه هادی است که با دریافت انرژی نور به سطوح بالاتری از انرژی بر انگیخته می شود و الکترون ها را از سطح تابش شده رها می سازد.اگر میزان انرژی کافی باشد همه الکترونها از سطح که نوار ظرفیت (Valence band) نامیده می شود به نوار ظرفیت هدایتی Conduction band جهش می یابند.انرژی که به این سطح داده می شود از نوع انرژی نورانی است که مربوط به طول موج نور تابیده می باشد.از میزان جهش الکترونها چنین بر می آید که محدوده تابش نور UV می باشد.
انواع فتو کاتالیست ها:
شناساگرها
اطلاعات اولیه
انواع گوناگونی از ترکیبات ، هم سنتزی و هم طبیعی وجود دارند که بر حسب PH محلولی که در آن حل میشوند، رنگ متفاوتی به خود میگیرند. بعضی از این مواد هزاران سال است که برای نشان دادن خصلت اسیدی یا بازی آبها بکار گرفته شدهاند. این ترکیبات همچنین برای شیمیدان عصر حاضر که از آنها برای تخمین PH محلولها و تشخیص نقطه پایانی در تیتراسیونهای اسید – باز سود میبرند، اهمیت زیادی دارند.
رنگ شناساگر 
محلولی که محتوی یک شناساگر باشد، با تغییرات PH ، یک تغییر پیوسته در رنگ از خود ظاهر میسازد. لکن ، چشم انسان به این تغییرات حساس نیست. نوعا از یک گونه باید پنج تا ده برابر بطور اضافی موجود باشد تا رنگ آن گونه به چشم بیننده یک رنگ غالب به نظر آید. افزایش بیشتر در این نسبت هیچ تاثیر قابل روئیتی ندارد. فقط در ناحیهای که نسبت از پنج تا ده برابر برای یک شکل به نسبت مشابهی برای یک شکل تغییر کند، بنظر میآید که رنگ محلول تغییر کرده است.
پس ، تغییر رنگ صوری شامل یک تغییر عمده در وضعیت تعادل شناساگر است. بعضی از شناساگرها نیاز به تغییر نسبت کمتری دارند و بعضی دیگر ، به تغییر بیشتر. بعلاوه ، تفاوت قابل توجهی نیز در توان افراد مختلف جهت تشخیص رنگ وجود دارد. در حقیقت ، شخص مبتلا به کور رنگی ممکن است قادر به تشخیص هیچ گونه تغییر رنگی نباشد.
دامنه PH برای تغییر رنگ
ادامه مطلب ...کتون ها
کتون ها

R۱(CO)R۲
اتم کربن که با دو اتم کربن پیوند دارد آن را از گروههای عاملی کربوکسیلیک اسیدها ، آلدهیدها، استرها، آمیدها و دیگر ترکیبهای اکسیژندار جدا میکند. پیوند دوگانهٔ گروه کربونیل نیز کتونها را از الکل ها و اترها باز میشناساند.
به کربنی که به کربن گروه کربونیل چسبیده کربن آلفا و به هیدروژنی که به این کربن چسبیده هیدروژن آلفا گویند. در حضور یک کاتالیزور اسیدی کتون به keto-
آشکار سازهای کروماتوگرافی
آشکارساز هدایت گرمایی ( T.C.D) :
اساس این آشکارساز بر روی درجه از دست دادن حرارت از فیلامانها به گاز اطراف خود می باشد و از دست دادن حرارت بستگی به ترکیب گاز دارد. هدایت حرارتی اغلب ترکیبات آلی از گاز حامل بیشتر است. در اثر گرم شدن سیم پیچها شدت جریان عبوری کاهش می یابد.
عوامل موثر در حساسیت آشکارساز :
1- جریان الکتریکی : هر چه جریان بیشتر شود حساسیت زیادتر خواهد شد ولی افزایش بیش از حد باعث سوختن فیلامانها خواهد شد .
2- گاز حامل : هر چه قابلیت هدایت گرمایی گاز حامل بیشتر باشد حساسیت بیشتر خواهد شد به همین جهت گاز هلیم و هیدروژن برای این آشکارساز مناسب می باشد ولی هیدروژن به دلیل قابل انفجار بودن کمتر مورد استفاده قرار می گیرد .
3- درجه حرارت : افزایش شدت جریان باعث افزایش درجه حرارت فیلامانها شده که نتیجه آن افزایش حساسیت آشکارساز می باشد .
رعایت نکات زیر هنگام کار با T.C.D ضروری است :
1- قبل از روشن نمودن آشکارساز گاز حامل را در سرویس قرار داده و از خروج گاز از خروجی آشکارساز مطمئن شوید .
2- هنگام خاموش کردن دستگاه ، ابتدا جریان فیلامانها را قطع کرده اجازه دهید درجه حرارت آشکارساز پایین آید سپس جریان گاز را قطع کنید .
3- هنگام تعویض ستون ، یا Septum و یا هر تغییر دیگر جریان عبوری از فیلامانها را قطع کنید چون وجود اکسیژن باعث اکسیده شده فیلامانها گشته ، حساسیت آشکارساز را کم خواهد کرد .
4- تزریق نمونه هایی نظیر اسید کلرید ریک ، الکیل هالیدها وترکیبات خورنده به آشکارساز صدمه خواهد زد .
آشکارساز یونیزاسیون شعله ای : ( F.I.D)
اساس این آشکارساز برروی قابلیت هدایت الکتریکی گاز که بستگی به ذرات باردار دارد قرار دارد . گاز خروجی از ستون همراه با نمونه بین دو الکترود وارد شده ، یونیزه می شوند .
اکثر ترکیبات آلی هنگامی که در دمای شعله هیدروژن-هوا، گرماکافت میشوند، واسطه های یونی تولید میکنند که مکانیسمی را در اختیار میگذارند که توسط آن الکتریسیته میتواند از درون شعله عبور کند.
عمل یونیزاسیون در شعله بدرستی روشن نیست و ممکن است یکی از حالتهای زیر اتفاق بیافتد .
1- تشکیل یون H3O + و اگزوترمیک بودن فعل و انفعال باعث عمل یونیزاسیون می شود.
2- یونیزاسیون توسط شعله ایجاد شده در آشکارساز .
3- تشکیل رادیکال آزاد که اگزوترمیک می باشد باعث عمل یونیزاسیون می شود . به هر حال در اثر یونیزاسیون یک میکرو جریان به وجود آمده که پس از تقویت توسط یک الکترومتر به صورت یک سیگنال به ثبات فرستاده می شود .
فاصله بین دو الکترود مانند یک مقاومت متغیر عمل کرده و مقدار مقاومت از روی تعداد ذرات باردار معین می شود . شعله ایجاد شده در این آشکارساز حاصل مخلوط هوا و هیدروژن می باشد . ناخالصی های موجود در گاز حامل و bleeding ستون همیشه یک جریان ثابتی از ذرات باردار بین دو الکترود ایجاد می نماید که به جریان زمینه موسوم می باشد که معمولا برای حذف این جریان از Bucking Votlage استفاده می شود تا خط مبدا بدون پارازیت باشد . برای استفاده از این آشکارساز در ماکزیمم حساسیت ،
نیاز به بهینه کرده سرعت جریان گازهای هوا و هیدروژن می باشد که معمولا هیدروژن و هوا می باشد و دامنه خطی آشکارساز 107 می باشد .
آلوده شدن FID و تمیز کردن آن :
آلودگی در این آشکارساز به سه دسته تقسیم می شوند ؛
1- آلوده شدن توسط فاز مایع
2- آلوده شدن در اثر استفاده از حلالهایی نظیر بنزن و تولوئن
3- آلوده شدن توسط آب
فازهای مایع سیلیکونی به دلیل تشکیل SiO2 در شعله باعث آلوده شدن این آشکارساز شده و وجود ذرات SiO2 در قسمتهای Jet , Collector Ion سبب نوساناتی در خط مبدا خواهد شد در چنین مواردی باید دتکتور را باز کرده قسمت های آلوده شده را با حلال مناسب و یا سمباده نرم تمیز نمود .
استفاده از حلالهایی نظیر بنزن و تولوئن در شعله ایجاد دوده نموده و آلوده شدن قسمتهای مختلف سبب نوساناتی در خط مبدا خواهد شد که باید آشکارساز تمیز گردد .
در صورت پایین بودن درجه حرارت آشکارساز آب تشکیل شده در شعله آنرا آلوده کرده که برای رفع آن کافی است درجه حرارت آشکارساز بالاتر از 120°c انتخاب شود .
محاسبه نسبت بار به جرم الکترون
جوزف تامسون چگونه نسبت بار به جرم الکترون رااندازه گیری کرد؟
آزمایش تامسون ( محاسبه نسبت بار به جرم الکترون )
در آزمایش تامسون از اثر میدان الکتریکی و میدان مغناطیسی استفاده شده است. دستگاهی که در این آزمایش مورد استفاده قرار گرفته است از قسمتهای زیر تشکیل شده است:
الف ) اطاق یونش که در حقیقت چشمه تهیه الکترون با سرعت معین می باشد بین کاتد و آند قرار گرفته است. در این قسمت در اثر تخلیه الکتریکی درون گاز ذرات کاتدی ( الکترون ) بوجود آمده بطرف قطب مثبت حرکت می کنند و با سرعت معینی از منفذی که روی آند تعبیه شده گذشته وارد قسمت دوم می شود. اگر بار الکتریکی q تحت تاثیر یک میدان الکتریکی بشدت E قرار گیرد، نیروییکه از طرف میدان بر این بار الکتریکی وارد می شود برابر است با:
F= q.E
در آزمایش تامسون چون ذرات الکترون می باشند q = -e بنابراین:
F= -eE
از طرف دیگر چون شدت میدان E در جهت پتانسیلهای نزولی یعنی از قطب مثبت بطرف قطب منفی است بنابراین جهت نیرویF در خلاف جهت یعنی از قطب منفی بطرف قطب مثبت می باشد. اگرx فاصله بین آند و کاتد باشد کار نیروی F در این فاصله برابر است با تغییرات انرژی جنبشی ذرات .
از آنجاییکه کار انجام شده در این فاصله برابراست با مقدار بار ذره در اختلاف پتانسیل موجود بین کاتد وآند بنابراین خواهیم داشت :
ev0 =½m0v2
که در آن v0 اختلاف پتانسیل بین کاتد و آند e بار الکترون v سرعت الکترون و m0 جرم آن می باشد. بدیهی است اگر v0 زیاد نباشد یعنی تا حدود هزار ولت رابطه فوق صدق می کند یعنی سرعت الکترون مقداری خواهد بود که می توان از تغییرات جرم آن صرفنظ نمود . بنابراین سرعت الکترون در لحظه عبور از آند بسمت قسمت دوم دستگاه برابر است با:
v = √(2e v0/ m0)
ب) قسمت دوم دستگاه که پرتو الکترونی با سرعت v وارد آن می شود شامل قسمتهای زیر است :

ادامه مطلب ...
پرتو کاتدی
● چگونگی شکل گیری پرتوهای کاتدی وقتی مقدار گاز داخل لوله تخلیه الکتریکی کاهش مییابد، فضای تاریک کاتد ، بیشتر و ستون مثبت کوتاهتر و روشنایی آن کمتر میشود. با کاهش بیشتر فشار تابانی باز هم ضعیفتر میشود و شیشه لوله در مجاورت کاتد شروع به تابانی مختصری میکند. وقتی که فشار تا ۰.۰۰۱میلیمتر جیوه افت کند، تابانی گاز عملا متوقف میشود، درحالی که تمام سطح شیشه لوله ، نور درخشانی (معمولا سبز) گسیل میدارد.
اگر هوا باز هم با پمپ تخلیه بیشتر خارج شود، تابانی شیشه سبز ضعیفتر میشود. با شروع فشار از ۰.۰۰۰۰۱ تا ۰.۰۰۰۱ میلیمتر جیوه این تابانی بکلی محو میشود و تخلیه خاتمه میپذیرد.
روشهای تشخیص نقطه اکی والان:
روشهای تشخیص نقطه اکی والان:
اصولا" نقطه اکی والان زمانی بدست می آید که آنالیت با تیترانت با نسبت استکیومتری مربوطه به طور کامل واکنش دهند. اگر تیتراسیون را به عنوان " شمارش یونها یا مولکولها " بدانیم، بدست آوردن نقطه اکی والان باید خیلی مهم باشد. انجام این کار می تواند با استفاده از خواص بعضی محلولها به عنوان شناساگر رنگی که در بهترین حالت در نقطه اکی والان تغییر رنگ می دهند، انجام شود.
اما این تغییر رنگ در نقطه پایان اتفاق می افتد نه در نقطه اکی والان با اینکه نقطه پایان بسیار نزدیک به نقطه اکی والان است . اما همواره در این روش انتشار خطا خواهیم داشت از آن گذشته تشخیص افراد مختلف در تشخیص رنگ بسیار متفاوت است. اصولا" تشخیص نقطه اکی والان به سه روش مرسوم انجام می پذیرد : ● روش چشمی یا فتومتری ● روش پتانسیومتری ● روش بی ولتامتری/بی آمپرومتری
◄ اساس روش پتانسیوتری : روش پتانسیومتری یکی از متداول ترین روشهای تشخیص نقطه اکی والان است این روش تشخیص ، کل تیتراسیونهای آبی ، غیر آبی اسید و باز ، اکسیداسیون احیاء ، رسوبی و کمپلکسومتری را پوشش می دهد .
اساس تشخیص نقطه اکی والان به این روش مبتنی بر دو الکترود می باشد ، یکی الکترود شناساگر و دیگری الکترود مرجع و چیزی که در اینجا اندازه گیری می شود پتانسیل الکترود ها نیست بلکه تفاضل پتانسیل بین الکترود شناساگر و الکترود کار در هر لحظه می باشد. در واقع الکترود شناساگر پتانسیلی را تامین می نماید که وابسته به وضعیت محلول داخل ظرف تیتراسیون می باشد. و الکترود مرجع عهده دار تامین پتانسیلی است که کاملا" مستقل از وضعیت محلول داخل ظرف تیتراسیون است . این اختلاف پتانسیل بین دو الکترود توسط یک ولتامتر اندازه گیری می شود که مقاومت داخلی بسیار بالایی دارد.
رابطه تئوری اندازه گیری این اختلاف پتانسیل به قرار زیر می باشد

R= ثابت گازها ( 8.314 J/K/mol )
U= اختلاف پتانسیل بین دو الکترود
Uo= پتانسیل الکترود شناساگر
Zi= بار یونی
F= عدد فارادی ( 96484.56 C/mol )
ai= فعالیت یونی
◄ دستگاههای تیتراسیون های پتانسیومتری: همانطور که در قبل نیز شرح داده شد این روش نیاز به مدار الکتریکی به نام ولتمتر دارد که دارای مقاومت داخلی بالایی باشد. امروزه دستگاههای ولت متر ساخته شده برای این منظور تنها یک ولتمتر ساده نیست . این دستگاهها علاوه بر وظیفه اصلی که به عهده دارند که همانا پیدا کردن حجم مصرفی از تیترانت در نقطه اکی والان است بسیار پیشرفته تر شده ، می توانند پس از پیدا کردن این نقطه اطلاعات را نیز توسط فرمولی که خود کاربران برای آنها تعریف می کنند پردازش نمایند و نتیجه را به صورت مستقیم با دیمانسیون و تعداد ارقام پس از اعشار تعیین شده به نمایش در آورند .
علاوه بر آن اطلاعات حاصل از هر آزمایش را می توان توسط کامپیوتر ذخیره یا توسط دستگاه چاپگر نمود که از این طریق به کاربران اجازه می دهند تا بانک اطلاعاتی تیتراسیون را در آزمایشگاه خود داشته باشد تا هر زمان که نیاز بود بتوانند به نتیجه آزمایشی در روز خاصی رجوع کرده آن را ملاحظه یا چاپ نماید. در نسل جدید این دستگاه کاربر قادر خواهد بود حتی تیترانت خود را در پله های i0.05µLit اضافه نماید .یکی از کمپانی هایی که بیش از 65سال در ارتباط با تولید این نوع دستگاهها در جهان سابقه کار دارد کمپانی Metrohm سوئیس است که در 65 سال پیش در شهر کوچکی در کشور سوئیس بوجود آمد و تا به امروز که تبدیل به بزرگترین کمپانی در این ارتباط شده است . دستگاههایی که در این کمپانی امروزه برای تیتراسیون تولید می کند ، در دو نسل Titrando, Titrino تولید می شوند .
جدیدترین مدل این دستگاهها دارای قابلیت های منحصر به فردی می باشد که در جهان بی همتاست استفاده از تکنولوژی میکرو الکترو مکانیک، استفاده از بورتهای هوشمند، استفاده از الکترود هوشمند، تبدیل پتانسیل الکترود از آنالوگ به دیجیتال امکان انجام دو تیتراسیون به صورت همزمان از توانمندی های منحصر به فرد این دستگاه ها می باشد. یکی دیگر از تیتراسیونهای نام آشنا در صنایع نفت و گاز و پتروشیمی تیتراسیون کارل فیشر می باشد در این تیتراسیون که I2 به عنوان تیترانت در تیتراسیونی با استکیومتری یک به یک با آب بعنوان آنالیت واکنش می دهد و شما با اندازه گیری مقدار مصرف I2 به آب نمونه مجهول پی می برید.
کمپانی یاد شده بزرگترین و دقیق ترین این دستگاهها را تولید می نماید از دیگر تیتراسیونهای نام آشنا در صنعت نفت و گاز و پتروشیمی می توان اندازه گیری H2S، مرکاپتان ، برم نامبر ، برم ایندکس TAN,TBN را نام برد.
Micro-NMR System
Overview
Nuclear Magnetic Resonance (NMR) is widely used in medical diagnostics and chemical analysis. Due to rapid growing of the NMR applications, the conventional NMR systems may not fulfill the need of all applications. For example, in some applications of chemical or biological analysis, such as microspectroscopy and NMR-detected microseparation, the test samples are very small—typical volume is around or below a microliter. The microliter-volume sample brings up a challenge in NMR system design because the signal-to-noise ratio in an NMR system is linearly dependent on the volume of the sample. It is necessary to develop a micro-NMR device that can exploit a volume-limited sample very efficiently as the existing NMR devices are usually designed for larger samples where the SNR is not the major design constraint. We also hope the development of a highly integrated micro-NMR device could further expand the application realm of NMR because conventional NMR equipment, including desktop NMR equipment, are relatively large and their
applications are limited because of the siz.
مرجع:
http://www.cem.msu.edu/~reusch/VirtualText/Spectrpy/nmr/nmr1.htm
.http://www.cs.cmu.edu/~wclin/nmr.htm
آب تبلور به چه معناست؟
آب تبلور به چه معناست؟
آب تبلور آبی است که به همراه مولکولهای بعضی بلورهای جامدهای یونی است. هنگامی که یک جامد یونی از محلول آبی متبلور می شود به عنوان مثال باریم کلرید محلول در آب است و ما به وسیلهی تبخیر یک مقدار از محلول و اشباع کردن محلول، مقداری بلور BaCl2 به دست می آوریم. در این هنگام تعدادی از مولکولهای آب در شبکه بلور به دام افتاده و با بلور پیوندهای ضعیف واندروالسی برقرار می کند. در این هنگام ما به جای BaCl2 خالص، نمک متبلور آن را داریم و فرمول آن به صورت ((BaCl2, 2H2O(s) می باشد. به این گونه بلورهای نمکی که با مولکولهای آب همراه هستند، هیدرات و به آبی که این بلورها را همراهی می کند و در شبکه ی بلوری این نمکها وارد شده است، آب تبلور گفته می شود. مثال دیگر از این دست، سولفات مس هیدراته است که دارای 5 مولکول آب تبلور می باشد:( (CuSO4, 5H2O (s)
معمولا ً ظاهر هیدراتها با ترکیبات بی آب آنها کاملا ً تفاوت دارد. به طور معمول، هیدراتها بلورهای نسبتا ً بزرگ و غالبا ً شفاف تشکیل می دهند. هیدراتها بر اثر گرم شدن تجزیه می شوند و آب تبلور خود را به صورت بخار آب از دست می دهند.
ادامه مطلب ...