شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.اورانیوم چیست؟
خصوصیتهای قابل توجه
اورانیوم هنگام عمل پالایش به رنگ سفید مایل به نقره ای فلزی با خاصیت رادیو اکتیوی ضعیف می باشد که کمی از فولاد نرم تر است. این فلز چکش خوار ، رسانای جریان الکتریسیته و کمی PARAMAGNETIC می باشد. چگالی اورانیوم 65% بیشتر از چگالی سرب میباشد. اگر اورانیوم به خوبی جدا شود به شدت از آب سرد متاثر شده و در برابر هوا اکسید میشود. اورانیوم استخراج شده از معادن می تواند به صورت شیمیایی به دی اکسید اورانیوم و دیگر گونه های قابل استفاده در صنعت تبدیل شود.
اورانیوم در صنعت سه گونه دارد:
• آلفا (ORTHOHOMBIC) که تا دمای 667.7 درجه پایدار است.
• بتا (TETRAGONAL) که از دمای 667.7 تا 774.8 درجه پایدار است.
• گاما (BODY-CENTERED CUBIC) که از دمای 774.8 درجه تا نقطه ذوب پایدار است. ( این رساناترین و چکش خوارترین گونه اورانیوم می باشد.)
دو ایزوتوپ مهم ان U235 و U238 می باشند که 235 Uمهمترین ایزوتوپ برای راکتورها و سلاحهای هسته ای است. چرا که این ایزوتوپ تنها ایزوتوپی است که در طبیعت وجود دارد و در هر مقدار ممکن توسط نوترونهای حرارتی شکافته میشود. ایزوتوپ U238 نیز از این جهت مهم است که نوترونها را برای تولید ایزوتوپ رادیو اکتیو جذب کرده و آن را به ایزوتوپ PU239 پلوتونیوم تجزیه می کند. ایزوتوپ مصنوعی U233 نیز شکافته شده و توسط بمباران نوترونی THORIUM232 بوجود می آید.
اورانیوم اولین عنصر یافته شده بود که می توانست شکافته شود. برای نمونه با بمباران آرام نوترونی ایزوتوپ U235 آن به ایزوتوپ کوتاه عمر U236 تبدیل شده و بلا فاصله به دو هسته کوچکتر تقسیم می شود که این عمل انرژی آزاد کرده و نوترونهای بیشتری تولید می کند. اگر این نوترونها توسط هسته U235 دیگری جذب شوند عملکرد حلقه هسته ای دوباره اتفاق می افتد و اگر چیزی برای جذب نوترونها وجود نداشته باشد به حالت انفجاری در می آیند. اولین بمب اتمی با این اصل جواب داد «شکاف هسته ای » نام دقیقتر برای این بمبها و بمب های هیدروژنی« آمیزش هسته ای» سلاحهای هسته ای می باشد.
کاربردها:


مسمومیت نیتراتی
مسمومیت نیتراتی
نیترات ترکیبی است شیمیایی که به صورت طبیعی د ر ساختار بدن موجود زنده نیز تولید میشود.برای گیاهان منبع مهم نیتروژن برای پروتئین سازی بحساب می آید.برای باکتریها نیز به عنوان منبع نیتروژنی استفاده می شود. باکتریهای دستگاه گوارش در تک معده ایها و نشخوار کنندگان (چند معده ایها) از نیترات موجود در آب و غذای مصرفی استفاده می کنند و بر روی آن تغییراتی ایجاد می کنند تا نیتروژن آن قابل استفاده برای ساختن پروتئینها باشد. این تغییرات یک سری واکنشهای احیایی است. در مسیر این واکنشها ترکیبات دیگری تولید می شوند که همگی متابولیتهای نیترات بحساب می آیند. مهمترین آنها را میتوان نیتریت ( NO۲ ) و یون آمونیوم ( NH۴+ ) ذکر کرد.
نیترات خودش مضر نیست این نیتریت است که سم است.نیترات بکمک آنزیم نیترات ردوکتاز به نیتریت تجزیه میشود.این آنزیم در گیاهان وجود دا رد . برخی گونه های خاص باکتریایی و با فتهای بدن پستانداران هم این آنزیم را دارند. به این ترتیب می توان این نتیجه را پیشگویی کرد که احیای نیترات به نیتریت همانگونه که در شکمبه یا سکوم قابل انجام است در بافتهای گیاهی و سیلوها نیز انجام پذیر است. دامهای نشخوار کننده و اسبها نسبت به غیر نشخوار کنندگان به مسمومیت نیتراتی حساسترند.
آلیاژبرنج
آلیاژبرنج
برنج آلیاژی از مس و فلز روی میباشد که نسبت آندو در آلیاژ تعیین کننده نوع برنج با توجه به مورد استفاده آن است. برخی از انواع برنجها برنز هم نامیده میشوند هرچند برنز آلیاژی از مس و قلع میباشد.
از این فلز به خاطر کاربردهای خاص و شکل و رنگ آن در جاهای مختلفی استفاده می کنند: مثلاً در دکوراسیون به خاطر رنگ تقریباً طلایی رنگش، در مهمات جنگی، در جاهایی که به اصطکاک کم نیاز باشد (مثل مغزی قفلها)، و مخصوصاً بخاطر خاصیت آکوستیکی در سازهای موسیقی (مثل هورن).
برنج رنگی تقریباً زرد دارد که شبیه به رنگ طلا است. برنج در برابر کدر شدن و لکهدار شدن هم مقاومت دارد، یعنی دیرتر اکسایش می یابد.
برنج از مدتها پیش حتی قبل از تاریخ شناخته شده بود؛ در آن زمان که انسان هنوز فلز روی را نمی شناخت با ذوب کردن مس همراه با کالامین (سنگ معدن فلز روی) برنج تولید می کرد.
برنج معمولاً قابلیت چکشخواری بیشتری نسبت به مس و روی دارد و تقریباً دمای ذوب آن بین ۹۰۰ تا ۹۴۰ درجه سانتیگراد است . البته سختی و نرم بودن آن می تواند با تغییر نسبت مخلوط مس و روی تغیر کند.
مس داخل برنج (از طریق اثر اولیگودینامیک) خاصیت میکروبکشی به آن میدهد. بههمین خاطر از برنج به عنوان دستگیره و دیگر فلزات رایج در بیمارستانها استفاده میکنند.
امروزه تقریباً ۹۰٪ از فلزات برنج بازیافت می شوند، چون فلز برنج خاصیت مغناطیسی کمی دارد و به راحتی می توان آن را از فلزاتی که معمولاً با آنها مخلوط می شود جدا کرد. بدین ترتیب برنج جدا شده را دوباره بازیافت می کنند.
چگالی متوسط برنج ۸٫۴ گرم بر سانتیمتر مربع است .
ادامه مطلب ...اصول طیف سنجی جرمی
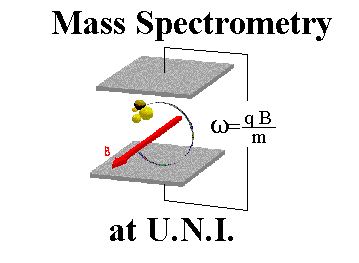
اصول طیف سنجی جرمی
به بیان ساده ، طیف سنج جرمی سه عمل اساسی را انجام میدهد:
مولکولها توسط جرایاناتی از الکترونهای پرانرژی بمباران شده و بعضی از مولکولها به یونهای مربوطه تبدیل میگردند. سپس یونها در یک میدان الکتریکی شتاب داده میشوند.
یونهای شتاب داده شده بسته به نسبت بار/جرم آنها در یک میدان مغناطیسی یا الکتریکی جدا میگردند.
یونهای دارای نسبت بار/جرم مشخص و معین توسط بخشی از دستگاه که در اثر برخورد یونها به آن ، قادر به شمارش آنها است، آشکار میگردند. نتایج داده شده خروجی توسط آشکار کننده بزرگ شده و به ثبات داده میشوند. علامت یا نقشی که از ثبات حاصل میگردد یک طیف جرمی است، نموداری از تعداد ذرات آشکار شده بر حسب تابعی از نسبت بار/جرم.
دستگاه طیف سنج جرمی
هنگامی که هر یک از عملیات را بدقت مورد بررسی قرار دهیم، خواهیم دید که طیف سنج جرمی واقعا پیچیدهتر از آن چیزی است که در بالا شرح داده شد.
سیستم ورودی نمونه
دستگاه احیاء مداوم کاتالیست
پس از پیدایش کاتالیست تک فلزی پلتفرمینگ در دهه 1940 میلادی همیشه سعی شده است که راههایی برای افزایش بازده، افزایش درجه آرام سوزی محصول، پایدار بهتر کاتالیست و کاهش مصرف انرژی ابداع گردد. با ساخت کاتالیست های دو فلزی در دهه 1960 میلادی یک گام بلند در جهت افزایش پایداری کاتالیست برداشته شد.
در سالهای دهه 1970 میلادی با پیداش تبدیل کاتالیستی مداوم (continuous platforming ) تولید بنزین موتور با درجه آرا مسوزی بالا و همچنین تولید آروماتیکها با مصرف انرژی کمتر و بازده بالاتر میسر گردید. کاهش فشار عملیاتی در این واحد متشکل طول عمر را ایجاد نمی کند زیرا کاتالیست بطور مداوم در حال..........
احیاء می باشد و کک بر روی کاتالیست تجمع پیدا نمی کند .
تبدیل کاتالیستی مداوم (continuous platforming) از دیدگاه فرایند تولید ، بسیار شبیه به روش قبلی (continuous platforming) میباشد و در واقع می توان در صورتیکه سرعت تشکیل کک ناچیز باشد ، این واحد را بصورت راهبری نمود ، هر چند چنین وضعیتی به ندرت اتفاق میافتد .[3]
واحد تبدیل کاتالیستی مداوم طوری طراحی شده است که حداقل افت فشار در مسیر راکتور و کورهها وجود داشته باشد و برای این منظور در ساخت واحد تغییرات زیر داده شده است :
1- از کوره با افت فشار کم و دارای پیش گرمکن هوا استفاده شده است . بازده (yield) این کوره بیش از 90 درصد است و قسمت آن برای این منظور تولید بخار و یا بعنوان باز جوشانده (reboiler) برج تثبیت (stabilizer) می توانند مورد استفاده قرار گیرد.
2- مبدل حرارتی عمودی V.C.F.E (vertical combined feed exchanger) این مبدلها بصورت یک پاس و جریان مخالف میباشند و اختلاف دما ی انتهای سرد آنها در طراحیی های اخیر از 60 به 25-30 درجه سانتیگراد کاهش داده شده است.
3- رآکتور هایی با جریان شعاعی: این راکتورها روی هم دیگر قرار داشته تا کاتالیست به کمک نیروی وزن خود از درون راکتور ها به طرف پایین حرکت کند.
سیستم گردش و احیا مداوم کاتالیست، واحد پلاتفرمر را قادر می سازد:
1- کاتالیست کک گرفته از راکتور ها به برج احیا و از آنطرف کاتالیست تازه احیا شده به راکتور ها بازگرداند شود.
2- کاتالیست بطور مداوم کک سوزی، اکسیده و کلره شود و عمل پخش پلاتین و احیا روی آن انجام پذیرد.
بطور کلی تبدیل کاتالیستی مداوم، امکانات زیر را برای صنایع پالایش فراهم نموده است:
1- فعالیت و بازده کاتالیست همیشه مشابه شرایط شروع راه اندازی حفظ شود.
2- حداکثر تولید محصولات مایع و هیدروژن تولیدی به واسطه کاهش فشار عملیاتی واحد تامین شود.
3- حداکثر افزایش درجه آرام سوزی محصول بطوریکه با نیازهای رو به افزایش بازار مصرف مطابقت داشته باشد.
با ابداع روش احیا مداوم کاتالیست در واحد تبدیل کاتالیستی، این امکان بوجود آمد که این واحد همواره در حین عملیات در شرایط ابتدای راه اندازی حفظ شود و نیاز به بستن آن جهت احیا کاتالیست بوجود نیاید. سیستم کامپیوتری کنترل اتوماتیک شیر آلات مربوط به لاک هاپر ها نیز ضامن عملکرد بدون اشکال احیا مداوم کاتالیست می باشد بطوریکه کاتالیست کک گرفته از راکتور ها به طرف برج احیا فرستاده شده، کک آن سوزانده شده، ترکیبات آن تنظیم می گردد و سپس به طرف راکتور شماره 1 بازگردانده می شود.
استفاده از سیستم ccr به صنایع پالایش انعطاف پذیری لازم را جهت مطابقت با تغییرات کیفی خوراک و شدت شرایط عملیات برای پاسخگویی به شرایط در حال تغییر بازار مصرف داده است.
بخش احیاء کاتالیست طراحی شده توسط شرکت UOP این امکان را ایجاد مینماید که بخش واکنش در سخت تر ین شرایط عملیات بتواند بدون وقفه به کار خود ادامه دهد. بخش احیاء کاتالیست بطور دائم کک بوجود آمده را میسوزاند و فعالیت کاتالیست را در حد کاتالیست نو ثابت نگه میدارد.[3]
احیاء کاتالیست:
چسب قطره ای و حلال آن
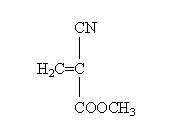
یکی از پر کاربرد ترین مواد در ساخت پروژه های دانش آموزی، چسب ها می باشند که از رایج ترین انواع آن می توان به چسب قطره ای اشاره نمود. نام علمی چسب قطره ای methyl Alpha cyanoacrylate یا متیل آلفا سیانو آکریلات می باشد.
بر خلاف چسب های دو جزئی مانند چسب دو قلو، چسب قطره ای تک جزئی می باشد و به کاتالیزر یا خشک کن خاصی نیاز ندارد. کاتالیزر یا خشک کن چسب قطره ای در حقیقت ذرات خارجی و قطرات آب بسیار ریز موجود روی سطوح می باشند.
این قطرات و ذرات در حقیقت باعث تسریع پلیمریزاسیون و سفت شدن چسب قطره ای می شوند. به همین دلیل با مصرف زیاد چسب قطره ای، چون لایه مجاور سطح سفت............
می شود، لایه های دیگر قادر نخواهند بود با سطوح تماس پیدا کنند و سفت شوند.
چسب قطره ای برای چسباندن و اتصال فلز به فلز، فلز- لاستیک، پلاستیک- لاستیک، لاستیک- لاستیک، فلز- پلاستیک، پلاستیک- سرامیک، سرامیک- کاغذ، فلز- شیشه، شیشه- چوب و... مناسب می باشد.
موازنه واکنشهای اکسایش- کاهش
دو روش برای موازنه واکنشهای اکسایش- کاهش بکار برده میشود: روش یون- الکترون و روش عدد اکسایش.
روش یون- الکترون برای موازنه معادلات اکسایش- کاهش
در موازنه معادلات به روش یون- الکترون ، دو دستور کار که کمی با هم متفاوتاند، مورد استفاده قرار میگیرد. یکی برای واکنشهایی که در محلول اسیدی انجام میگیرد و دیگری برای واکنشهایی که در محلول قلیایی صورت میپذیرد.
• مثالی برای واکنشهایی که در محلول اسیدی رخ میدهد، عبارت است:
Cr2O7-2 + Cl- → Cr+3 + Cl2
این واکنش موازنه نشده ، طی عملیات زیر موازنه می شود:
_ابتدا معادله را به صورت دو معادله جزئی که یکی برای نشان دادن اکسایش و دیگری برای نشان دادن کاهش است، تقسیم کرده و عنصر مرکزی را در هر یک از این نیم واکنش ها موازنه می کنیم:
Cr2O7-2 → 2Cr+3
2Cl- → Cl2
_اتمهای O و H را موازنه میکنیم. در سمتی که کمبود اکسیژن دارد، به ازای هر اکسیژن یک H2O اضافه میکنیم و در سمتی که کمبود هیدروژن دیده میشود، با افزودن تعداد مناسب +H آن را جبران می کنیم. در مثال بالا، طرف راست ، معادله جزئی اول 7 اتم اکسیژن کم دارد، پس به طرف مزبور 7H2O افزوده میشود. پس اتمهای H معادله جزئی اول را با اضافه کردن چهارده +H به طرف چپ معادله، موازنه میکنیم. معادله جزئی دوم ، بصورت نوشته شده ، از لحاظ جرمی ، موازنه است:
14H+ + Cr2O7-2 → 2Cr+3 + 7H2O
2Cl-→Cl2
_در مرحله بعد ، باید معادلات جزئی را از نظر بار الکتریکی موازنه میکنیم. در معادله جزئی جمع جبری بار الکتریکی طرف چپ برابر +12 و در طرف راست +6 است. 6 الکترون به سمت چپ اضافه میشود تا موازنه بار برای معادله جزئی اول حاصل شود. معادله دوم با افزودن دو الکترون به طرف راست ان موازنه میشود، ولی چون تعداد الکترونهای از دسترفته در یک معادله جزئی باید برابر تعداد الکترونهای بدست آمده در معادله جزئی دیگر باشد، بنابراین طرفین معادله جزئی دوم را در 3 ضرب میکنیم:
6e- + 14H+ +Cr2O7-2 → 2Cr+3 + 7H2O
6Cl- → 3Cl2 + 6e
_معادله نهایی ، با افزایش دو معادله جزئی و حذف الکترونها بدست میآید:
14H+ + Cr2O7-2 + 6Cl- → 2Cr+3 + 3Cl2 + 7H2O
• مثالی برای واکنش هایی که در محلول قلیایی صورت میگیرد:
MnO4- + N2H4 → MnO2 + N2
_معادله به دو معادله جزئی تقسیم می شود:
MnO4- → MnO2
N2H4→N2
_برای موازنه H و O در این واکنشها ، درسمتی که کمبود اکسیژن دارد، به ازای هر اتم اکسیژن -2OH و سمت دیگر یک H2O اضافه میکنیم و در سمتی که کمبود هیدروژن دارد به ازای هر اتم هیدروژن ، یک H2O و در سمت مقابل یک -OH اضافه میکنیم. سمت راست معادله جزئی اول دو اتم O کم دارد. لذا -4OH به سمت راست و 2H2Oبه سمت چپ میافزاییم:
2H2O + MnO4- → MnO2 + 4OH
برای موازنه جرمی معادله جزئی دوم ، باید چهار اتم هیدروژن به سمت راست اضافه کنیم، لذا 4H2O به سمت راست و -4OH به سمت چپ اضافه میکنیم:
-4OH + N2H4 → N2 + 4H2O
_برای موازنه بار الکتریکی ، هر جا لازم است، الکترون اضافه میکنیم و در این جا بطرف چپ معادله جزئی اول ، سه الکترون و بطرف چپ معادله جزئی دوم ، چهار الکترون افزوده میشود و برای موازنه کردن الکترونهای بدست آمده و از دست رفته ، مضرب مشترک گرفته و معادله اول را در 4 و معادله دوم را در 3 ، ضرب میکنیم:
12e- + 8H2 + 4MnO4- → 4MnO2 + 16OH
_جمع دو معادله جزئی، معادله نهایی را بدست میدهد:
4MnO4- + 3N2H4 →4OH- + 4MnO2 + 3N2 + 4H2O
روش عدد اکسایش برای موازنه واکنشهای اکسایش- کاهش
موازنه شامل سه مرحله است. برای مثال واکنش نیتریک اسید و هیدروژن سولفید را در نظر میگیریم. معادله موازنه نشده به قرار زیر است:
HNO3 + H2S→ NO + S + H2O
_برای تشخیص اتمهایی که کاهیده یا اکسیده میشوند، اعداد اکسایش آنها را از معادله بدست میآوریم:
نیتروژن کاهیده شده (از +5 به +2 ، کاهشی معادل 3 در عدد اکسایش) و گوگرد اکسید شده است (از -2 به صفر ، یعنی افززایشی معادل 2 در عدد اکسایش).
_برای ان که مجموع کاهش در اعداد اکسایش برابر با مجموع افزایش این اعداد باشد، ضرایبی متناسب به هر ترکیب نسبت میدهیم:
2HNO3 + 3H2S→2NO + 3S +H2O
_موازنه معادله را ، با بررسی دقیقتر ، کامل میکنیم. در مراحل پیشین تنها موازنه موادی مطرح شد که اعداد اکسایش انها تغییر میکند. در این مثال ، هنوز ضریبی برای H2O در نظر گرفته نشده است. ولی ملاحظه میشود که در سمت چپ واکنش 8 اتم H وجود دارد. همان سمت 4 اتم O نیز اضافی دارد. بنابراین ، برای تکمیل موازنه ، باید در سمت راست معادله ، 4H2O نشان داده شود:
2HNO3 + 3H2S → 2NO +3S + 4H2O
پس معادلات اکسایش- کاهش مانند واکنشهای الکتروشیمیایی و واکنش های یونی را میتوان با یکی از دو روش نامبرده موازنه کرد.
آدرس سایت 7879 دانشگاه 190 کشور جهان

World Listing - United States - Add Link - Help
با انتخاب گزینه World Listing می توانید نام کشور مورد نظر خود را انتخاب کنید
و بر روی دکمه Search کلیک کنید تا فهرست آدرس سایت دانشگاههای کشور
مورد نظر را به شما نشان دهد.
از شیمی آموختم ...
من از چرخش الکترون ها به دور هسته آموختم که کل جهان به دور مرکز هستی می چرخد و از حرکت پیوسته ذرات چه ارتعاشی چه انتقالی یا دورانی که ثبات و سکون در آفرینش راه ندارد و پیوسته در مسیر تغییر و تحول و تکامل هستیم.
از شیمی آموختم که هر چه فاصله ما از مرکز افرینش وخالق هستی بیشتر باشد ما و نیستی ما آسانتر خواهد بود همانطوری که جدا کردن الکترون از دورترین لایه اتم آسانتر است.
از تلاش ذرات بی شعور برای پایدار شدن متعجب شدم و دریافتم که شعوری والا و اندیشه ای برتر در پس پرده هدایت گر نقش ها و طرح هاست از پیوند اتم ها برای پایدارشدن دریافتم که اتحاد در مرز پایداری است و از گازهای نجیب کامل شدن را رمز پایداری یافتم.
از بحث واکنشهای چند مرحله ای و زنجیری آموختم که ما ذره های حد واسط مراحل زندگی هستیم که در یک مرحله واکنش متولد می شویم و در واکنشی دیگر می میریم و هدف آفرینش و خلقت فراتر از تولید و مصرف ماست.
از بحث تعادل های شیمیایی و واکنشهای برگشت پذیر آموختم که جهان تعادلی است پویا و دینامیک که گرچه در ظاهر خواص ماکروسکوپی ثابت و یا متغییری دارد اما در درون در تکاپو و فعال است
و از شیمی آموختم که از دست دادن فرصت ها واکنش های برگشت ناپذیری هستند که تکرار انها میسر نخواهد بود.
از شبکه بلور جامد های یونی آموختم که با وجود تضادها می توان چنان گرد هم آمد و پیوستگی ایجاد کرد که شبکه ای مقاوم در مقابل دماهای ذوب بالا بوجود آید..
با تشکر از دوست عزیز ( عظیمی دانشجوی ارشد شیمی )
راستی شما از شیمی چی آموختید؟
قلیائیت
قلیائیت به مقدار یونهایی که در آب وجود دارند و برای خنثی کردن یونهای هیدروژن در واکنش شرکت می کنند، اطلاق می شود. بدین ترتیب قلیائیت معیاری برای توانایی آب جهت خنثی سازی اسیدها به حساب می آید.
اجزای تشکیل دهنده قلیائیت در جدول زیر آمده است. این ترکیبات از تجزیه مواد معدنی موجود در خاک بوجود می آیند. فسفات می تواند از شویندها در خروجی فاضلابها، از کودهای شیمیایی و حشره کشها در زمین کشاورزی نیز بدست آید. سولفید هیدروژن و آمونیاک می تواند محصولات تجزیه میکروبی مواد آلی باشند.
HS- | HPO4-2 | HSiO3- |
HCO3- | NH3 | H2PO4- |
H2BO3- | OH- | CO3-2 |
معروفترین اجزای قلیائیت به ترتیب اهمیت عبارتند از
چگونگی تهیه بعضی از گازها
How to Prepare Gases
Chemistry Lab Instructions
You can use common chemistry lab chemicals and equipment to prepare several gases. A conical flask, thistle funnel, delivery tube, pneumatic trough, and beehive are useful items to have on hand. Please make sure you are familiar with the use and functioning of the laboratory equipment you use, are aware of the characteristics of the substances (toxicity, flammability, explosivity, etc.), and take proper safety precautions. Use a ventilation hood (fume cupboard) and keep flammable gases away from heat or flame. I've tried to be as accurate as possible in my instructions, but you use them at your own risk. For convenience, I've listed the gases in alphabetical order.
ادامه مطلب ...موازنه معادله یک واکنش شیمیایی
چند موازنه معادله واکنش شیمیایی به درخواست دوستان عزیز بازدید کننده:
الف - تشکیل آمونیاک
_ N2 + _ H2 ---> _ NH3
ب - واکنش های سوختن
_ CH4 + _ O2 ---> _ H2O + _ CO2
ج - موازنه معادلات یونی با یون های چند اتمی
_ Ag+(NO3)- + _ Ca2+Cl-2 ---> _ Ag+Cl- + _ Ca2+ (NO3) -2
د - موازنه معادلات یونی که آب محصول آن ها ست
برای اطلاع بیشتر لطفا به آدرس زیر مراجعه فرمایید.
مایعات یونی :
مایعات یونی :
این ترکیبات که بطور عمده شامل یک کاتیون آلی نامتقارن حجیم و یک آنیون آلی یا معدنی هستند اگرچه ماهیت نمکی دارند ولی به علت عدم تقارن در ساختار مولکولی شان دارای نقطه ذوب پائینی هستند بطوریکه درشرایط محیطی به فرم مایع به همین دلیل این ترکیبات ، مایعات یونی در دمای اتاق Room Temperature Ionic Liquids" " نامیده می شوند .
ادامه مطلب ...آشنایی با نانو الماس

آشنایی با نانو الماس
الماس از کربن خالص تشکیل شده و سیستم تبلور آن مکعبی ساده (Cubic) است. وزن مخصوص الماس g/cm 5 ضریب شکــست آن 42/2 و سختی آن در مقیاس موس ، مساوی 10 است [14و15]. الماس دارای مصارف صنعتی و زینتی است. گرچه الماس بیشتر به عنوان بخش زینت شناخته می شود، ولی بیش از 80 درصد آن به مصارف صنعتی میرسد. مصارف عمده الماس در صنعت جهت برش مواد بسیار سخت نظیر فولادهای آلیاژی و کاربید تنگستن ، ساییدن ، اره کردن سنگ و بتون و حفاریها و بخش عمده ای هم بعنوان افزودنی به روغن های روان کننده و روان کاوها بکار میرود.
خاک معدنی اورانیوم ( کیک زرد )
خاک معدنی اورانیوم ( کیک زرد )
Yellowcake
کیک زرد یا Yellowcake که بنام اورانیا (Urania) هم شناخته می شود در واقع خاک معدنی اورانیوم است که پس از طی مراحل تصفیه و پردازشهای لازم از سنگ معدنی آن تهیه می شود. تهیه این ماده به منزله رسیدن به بخش میانی از مراحل مختلف تصفیه سنگ معدن اورانیوم است و باید توجه داشت که فاصله بسیار زیادی برای استفاده در یک بمب اتمی دارد.
روش تهیه کیک زرد کاملآ به نوع سنگ معدن بدست آمده بستگی دارد، اما بطور معمول از طریق آسیاب کردن و انجام پردازش های شیمایی بر روی سنگ معدن اورانیوم، پودر زبر و زرد رنگی بدست می آید که قابلیت حل شدن در آب را ندارد و حدود ۸۰% غلظت اکسید اورانیوم آن خواهد بود. این پودر در دمایی معادل ۲۸۷۸ درجه سانتیگراد ذوب می شود.
رزینهای مبادله کننده یون
پدیده تبادل یون برای اولین بار در سال 1850 و به دنبال مشاهده توانایی خاکهای زراعی در تعویض برخی از یونها مثل آمونیوم با یون کلسیم و منیزم موجود در ساختمان آنها گزارش شد. در سال 1870 با انجام آزمایشهای متعددی ثابت شد که بعضی از کانیهای طبیعی بخصوص زئولیتها واجد توانایی انجام تبادل یون هستند. در واقع به رزینهای معدنی ، زئولیت میگویند و این مواد یونهای سختی آور آب (کلسیم و منیزیم) را حذف میکردند و به جای آن یون سدیم آزاد میکردند از اینرو به زئولیتهای سدیمی مشهور شدند که استفاده از آن در تصفیه آب مزایای زیاد داشت چون احتیاج به مواد شیمیایی نبود و اثرات جانبی هم نداشتند.
اما زئولیتهای سدیمی دارای محدودیتهایی بودند. این زئولیتها میتوانستند فقط سدیم را جایگزین کلسیم و منیزیم محلول در آب نمایند و آنیونهایی از قبیل سولفات ، کلراید و سیلیکاتها بدون تغییر باقی میمانند. واضح است چنین آبی برای صنایع مطلوب نیست. پس از انجام تحقیقات در اواسط دهه 1930 در هلند زئولیتهایی ساخته شد که به جای سدیم فعال ، هیدروژن فعال داشتند. این زئولیتها که به تعویض کنندههای کاتیونی هیدروژنی معروف جدید ، سیلیس نداشته و علاوه بر این قادرند همزامان هم سختی آب را حذف کنند و هم قلیائیست آب را کاهش دهند.
برای بهبود تکنولوژی تصفیه آب ، گامهای اساسی در سال 1944 برداشته شد که باعث تولید زرینهای تعویض آنیونی شد. زرینهای کاتیونی هیدروژنی تمام کاتیونی آب را حذف میکنند و رزینهای آنیونی تمام آنیونهای آب را از جمله سیلیس را حذف مینمایند ، در نتیجه میتوان با استفاده از هر دو نوع زرین ، آب بدون یون تولید کرد. همچنین پژوهشگران دریافتند که سیلیکات آلومینیم موجود در خاک قادر به تعویض یونی میباشد. این نتیجه گیری با تهیه ژل سیلیکات آلومینیم از ترکیب محلول سولفات آلومینیم و سیلیکات سدیم به اثبات رسید. بنابراین اولین رزین مصنوعی که ساخته شد سیلیکات آلومینیم بود. و امروزه اکثر زرینهای تعویض یونی که در تصفیه آب بکار میروند رزینهای سنتزی هستند که با پلیمریزاسیون ترکیبات آلی حاصل شدهاند.
◄ شیمی رزینها:
ادامه مطلب ...خطرات بجوش آوردن آب در ماکروفر
اگر از مایکروفر استفاده میکنید این مطلب بسیار مهم را بخوانید یک فرد 26 ساله جهت درست کردن یک فنجان قهوه، یک لیوان آب را در مایکروفر قرار داد(کاری که قبلا بارها انجام داده بود). دقیقا نمیدانم چه زمانی را روی دستگاه تنظیم کرد اما و به من گفت که قصد داشته آب به جوش برسد. وقتی که دستگاه خاموش میشود، ایشان لیوان محتوی آب را از مایکروفر خارج میکند. او میگوید وقتی لیوان را برداشتم آب نمیجوشید، اما بلافاصله تمام آب داخل لیوان بصورت انفجاری به صورتش پاشیده شد و لیوان سالم و خالی در دستش باقی ماند تازمانی که او لیوان را زمین انداخت. تمام صورتش تاول زد و دچار سوختگی درجه یک و دو گردید، به گونه ای که ممکن است جای زخمها بر صورتش بماند. همچنین ممکن است بخشی از بینایی چشم چپ ایشان از دست برود. زمانی که ایشان در بیمارستان بود، پزشک معالج ایشان گفت که موارد دیگری مشابه اتفاقی که برای ایشان افتاده مشاهده کرده است و هیچگاه نباید آب خالص را به تنهایی در دستگاه مایکروفر قرار داد. اگر قصد گرم کردن به این روش را داریم باید حتما چیزی درون لیوان قرار داده شود تا انرژی کسب شده توسط آب پخش گردد. مثلا یک همزن چوبی یا چای کیسه ای یا چیز دیگر. اما به هر حال بهترین راه جوش آوردن آب استفاده از کتری است و نه مایکروویو. |
توضیح: یکی از افرادی که این مطلب را توسط ایمیل دریافت کرده گویا برای تایید صحت مطلب فوق به شرکت جنرال الکتریک طی ایمیلی آن را گزارش میدهد. پاسخ شرکت جنرال الکتریک: از تماس شما متشکریم. خیلی خوشحال میشوم که بتوانم به شما کمکی کنم. ایمیلی که شما دریافت کردید صحیح است. آب یا هر مایعی که اشعه ی مایکروویو کسب میکند و به دمای جوش میرسد الزاما همیشه به حالت جوشش حباب نمایان نمیشود (و قل قل نمیکند). بلکه ممکن است دمای بسیار زیادی کسب کند اما همچنان بیحرکت و بدون حباب بماند و قل قل نکند مایع یا آبی که دمای فوق العاده زیاد را توسط امواج مایکروویو کسب میکند ممکن است پس از حرکت دادن و یا هم زدن و یا مثلا قراردادن چای کیسه ای در آن به حالت ظاهری جوشیدن برسد و قبل از آن هیچ نشانه ای از جوشیدن و دمای بالا از خود نشان ندهد. برای جلوگیری از این اتفاق و جلوگیری از صدمه دیدن هرگز هیچ مایعی را به اندازه یک لیوان، بیشتر از دو دقیقه در مایکروویو قرار ندهید. همچنین بعد از خاموش شدن مایکروفر اجازه دهید سی ثانیه مایع همچنان در مایکروفر باقی بماند و آن را قبل از سی ثانیه بیرون نیاورید.


