شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.روزانهها
همه- تصفیه آب
- کهکشان شیمی
- فرایندهای تصفیه آب و فاضلاب
- مدیریت اجرایی
- مهندسی نفت علوم و تحقیقات فارس
- آزمایشهای آب
- کتابخانه مجازی ایران- کتابهای شیمی
- تهدیر احمد دباغ
- وب سایت تکنولوزی صنعت نفت ایران
- دانلودستان مهندسی شیمی
- دانلود مقاله و پروژه های مهندسی شیمی
- مرکز شیمی
- پارک نانو فن آوری
- انجمن آیوپاک شیمی
- شیمی علم کیمیاگری
- خانه شیمی
- بهداشت حرفه ای تهران
- سایت بسیار مفید فدک
- مجله رشد شیمی
- وبلاگ تخصصی دانشجویان رشته شیمی
- سایت بسیار مفید در مورد آزمایشگاه
- About Chemistry
- لینک باکس اختصاصی شیمی
- مجله شیمیدان
- جستجوی کتابهای الکترونیکی
- اطلاعات علمی شیمی
- مقالات علمی نفت تایمز
- پالایشگاه شیراز
- دریافت اطلاعات ایمنی مواد شیمیایی
- جستجوی روشهای استاندارد ASTM
- دانلود نرم افزارهای شیمی
- مهدیس
- پرسش و پاسخ پالایشگاهی
- نازنین تخصصی صنعت نفت
پیوندها
- دیکشنری شیمی
- calculate the pH of a solution
- سایت علمی
- Nature nanotechnology
- دروس دانشگاه پیام نور
- رشد مدارس
- ایمنی و آتش نشانی
- خانه شیمی
- پژوهش سرای دانش آموزی رازی
- وبلاگ تخصصی شیمی
- گروه آموزشی شیمی منطقه چهاردانگه
- باشگاه دانش پژوهان جوان
- مجتمع فرهنگی آموزشی علامه طباطبایی
- شیمی علم کیمیاگری
- شوخی های شیمیایی
- رگبار آرامش
- آمار بروز جهان
- آزمایشهای آب
- دنیای رنگ
- آب و هوای شیراز
- NDT Education Resources
- بانک مقالات جوشکاری
- خوردگی
- corrosion-doctors
- مقالات خوردگی جدید
- کتاب
- حفاظت کاتدی
- حسن زاده آملی
- مقالات خوردگی
- کنترل خوردگی
- دانلود کتابهای صوتی
- جستجوی مطالب علمی
- پژوهشگاه شیمی و مهندسی شیمی ایران
دستهها
برگهها
جدیدترین یادداشتها
همه- تولید کیک گوگرد از گاز خروجی پالایشگاه ها
- MTBE (متیل ترسیو – بوتیل اتر)
- مایعات خنک کنندخ موتور خودرو
- قصه حسن کچل و اتمهای کربن
- کامپوزیت ها
- پیش از اینها فکر می کردم خدا....
- [ بدون عنوان ]
- شیمی برگهای پاییزی
- مواد هوشمند
- الکترونگاتیویته چیست؟
- علل فرسودگی و تخریب سازه های بتنی (causes Of Deteriorations)
- پیگمانها ـ رزینها ـ بایندرها و کاتالیستها در صنایع رنگ سازی
- سیستمهای پوشش دهی خطوط لوله
- استفاده از نانولولههای سیمانی برای تقویت بتن
- کاربرد مواد نانو متخلخل در پلیمریزاسیون فرایندهای فرایندهای پالایش نفت
- NDT یا آزمایشهای غیر مخرب بخش سوم
- NDT یا آزمایشهای غیر مخرب بخش دوم
- NDT یا آزمایشهای غیر مخرب بخش اول
- سندبلاست چیست ؟
- مقایسه روشهای پوشش دهی
- رادیو گرافی صنعتی (Radiographic testing )
- اصطلاحات رایج در خوردگی
- سنجش و کنترل خوردگی
- آستر رنگ
- سند بلاست ورنگ آمیزی صنعتی
- عیوب جوش
- بازرسی رنگ
- آماده سازی سطح جهت رنگ آمیزی
- خوردگی درخاکها
- ساینده های مورد استفاده در سندبلاست
- 'T-rays'
- شعری زیبا
- معرفی
- اوربیتالها
- اندازه گیری مواد معلق در آب ( TSS) :
- دخترم تولدت مبارک
- تفلون
- مشعل در صنعت
- کاتالیست های فرآیند کراکینگ
- اجزای تشکیل دهنده رنگ
نویسندگان
- احمد دیانت 778
بایگانی
- اسفند 1392 1
- آبان 1392 6
- مهر 1392 4
- شهریور 1392 22
- مرداد 1392 3
- تیر 1392 2
- خرداد 1392 2
- اردیبهشت 1392 1
- فروردین 1392 5
- اسفند 1391 1
- بهمن 1391 5
- دی 1391 9
- آذر 1391 8
- آبان 1391 5
- مهر 1391 11
- شهریور 1391 8
- مرداد 1391 8
- تیر 1391 3
- خرداد 1391 8
- اردیبهشت 1391 5
- فروردین 1391 10
- اسفند 1390 12
- بهمن 1390 9
- دی 1390 16
- آذر 1390 14
- آبان 1390 14
- مهر 1390 12
- شهریور 1390 5
- مرداد 1390 11
- تیر 1390 6
- خرداد 1390 6
- اردیبهشت 1390 7
- فروردین 1390 9
- اسفند 1389 11
- بهمن 1389 9
- دی 1389 15
- آذر 1389 12
- آبان 1389 8
- مهر 1389 10
- شهریور 1389 8
- مرداد 1389 10
- تیر 1389 5
- خرداد 1389 14
- اردیبهشت 1389 21
- فروردین 1389 10
- اسفند 1388 8
- بهمن 1388 11
- دی 1388 10
- آذر 1388 9
- آبان 1388 10
- مهر 1388 13
- شهریور 1388 2
- مرداد 1388 8
- تیر 1388 9
- خرداد 1388 9
- اردیبهشت 1388 21
- فروردین 1388 24
- اسفند 1387 22
- بهمن 1387 15
- دی 1387 15
- آذر 1387 34
- آبان 1387 41
- مهر 1387 32
- شهریور 1387 40
- مرداد 1387 51
- تیر 1387 13
انرژی های یونش بالاتر
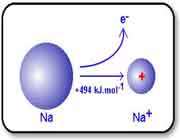
با اندکی مطالعه راجع به انرژی یونش و تشکیل یون های مختلف عناصر، متوجه می شوید که سدیم، منیزیم و آلومینیوم یون های Na+ و Mg2+ و Al3+ تشکیل می دهند. اما آیا تا کنون از خود پرسیده اید که چرا سدیم، یون های Na2+ یا حتی Na3+ تشکیل نمی دهد؟
جواب این سؤال می تواند از انرژی دومین، سومین و ... یونش عناصر به دست آید. به عنوان مثال، انرژی اولین یونش سدیم، انرژی لازم برای برداشتن یک الکترون از یک اتم سدیم خنثی است:
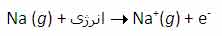
انرژی دومین یونش سدیم، انرژی لازم برای برداشتن یک الکترون دیگر از یون Na+ در حالت گازی است که یک یونNa2+تشکیل می دهد:
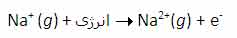
سومین انرژی یونش سدیم نیز به همین ترتیب است:
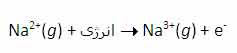
بنابراین انرژی لازم برای تشکیل یون Na3+ در فاز گازی، جمع انرژی های یونش اول، دوم و سوم این عنصر است.
برای کندن یک الکترون از اتم سدیم و تشکیل یون Na+ با آرایش الکترونی لایه پر، انرژی چندان زیادی لازم نیست اما وقتی یک بار این اتفاق افتاد، برای برداشتن دومین الکترون از سدیم تقریباً باید 10 برابر انرژی یونش اولیه، انرژی صرف شود تا آرایش لایه پر Na+ شکسته شود و Na2+ تشکیل شود. به دلیل این که انرژی زیادی برای برداشتن دومین الکترون سدیم در هر واکنش شیمیایی لازم است، سدیم می تواند با عناصر دیگر طوری واکنش دهد که ترکیباتی شامل یون های Na+ تشکیل دهد نه یون های Na2+ یا Na3+.
اولین، دومین، سومین و چهارمین انرژی یونش سدیم، منیزیوم و آلومینیوم (KJ/mol)
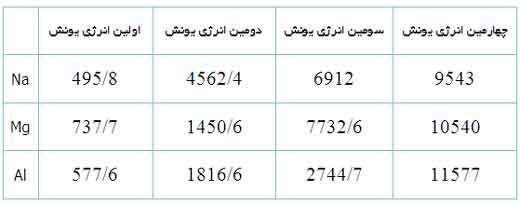
به دلیل این منیزیوم، یک پروتون بیش تر از سدیم دارد، اولین انرژی یونش آن بیش تر است تا الکترون ها در اوربیتال 3s نگه دارد:
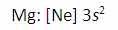
دومین انرژی یونش منیزیوم بزرگ تر از انرژی اولین یونش آن است زیرا همیشه برداشتن یک الکترون از یونی با بار مثبت، انرژی بیش تری می گیرد تا بخواهیم همین اکترون را از یک اتم خنثی برداریم. سومین انرژی یونش منیزیوم خیلی زیاد است زیرا Mg2+ آرایش پایدار و لایه پر دارد.
همین وضعیت راجع به آلومینیوم وجود دارد که اولین انرژی یونش آن از منیزیوم کم تر است. انرژی دومین و سومین یونش آلومینیوم از انرژی اولین یونش آن بزرگ تر است. اگرچه برداشتن سه الکترون از اتم آلومینیوم برای تشکیل یون Al3+مقدار انرژی زیادی لازم دارد اما انرژی لازم برای شکستن آرایش الکترونی پایدار یون Al3+ یک مقدار نجومی و عظیم است! بنابراین اشتباه است که به دنبال یون Al4+ به عنوان محصول یک واکنش شیمیایی باشیم.
مرجع: http://www.soltanieh.blogfa.com/post-714.aspx
از اینکه یکی از بینندگان وبلاگ زیبا و جالب شما هستم بسیار خوشحالم و امیدوارم همیشه موفق و پیروز باشید.
این گل تقدیم به شما و تمام بینندگان وبلاگ شما
شاد شاد شاد باشید
اگه مایل به تبادل لینک هستید وبلاگ |هند بوک ونرم افزار های شیمی| را با همین نام لینک کنید تا بنده نیز با کمال میل وبلاگ زیبای شما را لینک کنم
بدرود ...