شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.

شیمی کامپیوتری که نوبل 2013 را به خود اختصاص داد، چیست؟
شیمیدانهای سراسر جهان، هر روز بیش از پیش آزمایشهای خود را به کامپیوتر منتقل می کنند و به جای آزمایشگاه، انجام آن را به کامپیوتر خود میسپارند. مارتین کارپلوس، مایکل لویت و آریش وارشل به کمک شیوههایی که در دهه 1970/1350 پایهگذاری کردند، توانستند هر گام کوچک فرایندهای شیمیایی پیچیده را که برای چشم غیر مسلح رویتناپذیر است، به این ترتیب بیازمایند.
برای این که شما؛ خواننده گرامی؛ بفهمید نوع بشر چه سودی از این کار برده، یک مثال میزنیم. روپوش آزمایشگاه خود را بپوشید تا یکی از مهمترین واکنشهای شیمیایی روی زمین را شبیهسازی کنید: فوتوسنتز. واکنشهای شیمیایی رخ دهنده در برگهای سبز که جو زمین را سرشار از اکسیژن میکند، یکی از پیشنیازهای تشکیل حیات بر روی زمین است. ولی این مسئله از دید زیستمحیطی هم جذاب است. اگر بتوانید فوتوسنتز را شبیه سازی کنید، می توانید سلولهای خورشیدی پیچیدهتری بسازید. وقتی مولکولهای آب شکافته می شوند، اکسیژن آزاد می شود، ولی هیدروژن هم آزاد میشود که میتوان از آن برای حرکت دادن خودروها استفاده کرد. در نتیجه انگیزه کافی برای این که خود را درگیر این پروژه کنید، وجود دارد: اگر موفق به حل مسئله فوق شوید، گام بزرگی در جهت کمک به حل مسئله اثر گلخانهای برداشتهاید.
یک عکس بیش از هزار کلمه است؛ ولی همه چیز نیستبه عنوان گام اول، شاید بهتر باشد به سراغ اینترنت بروید و تصویری سه بعدی از پروتئینهایی بیابید که فوتوسنتز را مدیریت میکنند. چنین تصاویری بر روی اینترنت به رایگان قابل برداشتن هستند. میتوانید تصویر پیدا شده را روی کامپیوتر خود بچرخانید. این تصویر مولکولهای غولآسای پروتئینی را نشان میدهد که از دهها هزار اتم تشکیل شدهاند. جایی در آن میان، یک منطقه کوچک وجود دارد که مرکز واکنش نامیده میشود. این جایی است که مولکولهای آب تجزیه میشوند. ولی تنها چند اتم مستقیما در واکنش دخالت دارند. در میان چیزهای دیگر، میتوانید چهار یون منگنز، یک یون کلسیم و چندین اتم اکسیژن ببینید. این تصویر به وضوح نشان میدهد که اتمها و یونها چگونه در ارتباط با هم قرار میگیرند، ولی چیزی در مورد کاری که این اتمها و یونها انجام میدهند نمیگوید. این همان چیزی است که باید دریابید. الکترونها باید به ترتیبی از آب استخراج شوند و از چهار پروتون هم باید حفاظت شود. چگونه چنین چیزی رخ میدهد؟
تعیین جزئیات این فرایند با شیوههای سنتی شیمی غیر ممکن است. خیلی چیزها در کثری از یک هزارم ثانیه رخ میدهند؛ سرعتی که بیشتر از سرعت اکثر آزمایشهای شیمیایی معمولی است. تخمین فرایند واکنش، با کمک تصویری که روی کامپیوتر خود ذخیره کردهاید هم کار سختی خواهد بود، چون این عکس مربوط به وقتی است که پروتئین در حالت استراحت بوده است. وقتی نور خورشید به برگهای سبز برخورد میکند، پروتئینها پرانرژی میشوند و کل ساختار اتمی دچار تغییر میشود. برای درک واکنشهای شیمیایی، شما باید بدانید که حالت پرانرژی دقیقا چه شکلی است.
در این مرحله است که شما میتوانید از برنامههای کامپیوتری بهره ببرید که برندگان نوبل امسال، اصول آنها را مطرح کردهاند.
نظری و کاربردی؛ یک بده بستان موفقشما با استفاده از این نوع نرمافزار میتوانید انواع ممکن مسیرهای واکنش را محاسبه کنید. این کار، شبیهسازی یا مدلسازی نامیده میشود. در این حالت، شما میتوانید بفهمید که هر اتم در مراحل متفاوت واکنش شیمیایی، چه نقشی را بازی میکند و وقتی یک مسیر احتمالی ممکن برای انجام واکنش شیمیایی داشته باشید، انجام آزمایشهای واقعی برای آزمودن صحت شبیهسازی کامپیوتری سادهتر میشود. در عوض این آزمایشها، میتوانند اطلاعات بیشتری به دست بدهند که خود برای تهیه شبیهسازیهای بهتر به کار میروند؛ روشهای نظری و کاربردی، در یک بده بستان، همدیگر را تقویت میکنند. در نتیجه، اکنون شیمیدانها زمان بیشتری را پشت کامپیوتر خود سپری میکنند تا جلوی لولههای آزمایش.

پس چه نکته ویژهای در مورد برنامههای کامپیوتری وجود دارد که منجر به جایزه نوبل امسال شیمی برای نویسندگان آنها شد؟
ترکیب بهترینهای دو دنیاپیش از این، هنگامی که دانشمندان میخواستند مولکولها را روی کامپیوتر شبیهسازی کنند، از نرمافزارهایی استفاده میکردند که بر مبنای اصول فیزیک کلاسیک نیوتنی یا فیزیک کوانتوم نوشته شده بودند. هر دوی اینها نقاط قوت و ضعف خود را داشتند. نرمافزارهای فیزیک کلاسیک میتوانستند مولکولهای بزرگ را محاسبه و پردازش کنند. هرچند آنها فقط می توانستند مولکولها را در حال استراحت نشان دهند، ولی به خوبی به فیزیکدانها نشان میدادند که آرایش اتمها در مولکول چگونه است. با این وجود، نمیتوانستید از این برنامهها برای شبیه سازی واکنشهای شیمیایی استفاده کنید. در جریان واکنش، مولکولها پر از انرژی شده و برانگیخته میشوند. فیزیک کلاسیک هیچ درکی از این حالتها ندارد، که محدودیت بزرگی برای آن است.
هنگامی که دانشمندان میخواستند واکنشهای شیمیایی را شبیه سازی کنند، مجبور بودند به فیزیک کوانتوم رو بیاورند؛ همان نظریه عجیبی که در آن الکترون ها میتوانند همزمان هم موج باشند و هم ذره، و گربه شرودینگر در آن جعبه معروف میتواند همزمان هم زنده باشد و هم مرده. قدرت فیزیک کوانتوم در این است که پیش فرضی ندارد و مدلسازی انجام شده با آن، حاوی هیچ یک از پیش فرضهای دانشمندان نیست. در نتیجه چنین شبیه سازیهایی واقعیترند. اما مشکل کار اینجا است که محاسبات آنها نیاز به نیروی پردازشی بیشتری دارد. کامپیوتر باید هر الکترون و هر هسته اتمی در مولکول را جداگانه پردازش کند. این را میتوان با تعداد پیکسلها در یک عکس دیجیتال مقایسه کرد. تعداد زیاد پیکسلها به شما کیفیت بالای تصویر را میدهد، ولی منابع بیشتری را از کامپیوتر مصرف میکند. محاسبات فیزیک کوانتوم هم مشابه تصاویر با کیفیت هست، توصیف دقیقتری از فرایند واکنشهای شیمیایی به دست میدهد، ولی نیاز به کامپیوترهای قویتری هم دارد. در دهه 1970/1350، این بدان معنی بود که دانشمندان تنها میتوانستند محاسبات پردازشی خود را بر روی مولکولهای کوچک انجام دهند. علاوه بر این، به رغم اینکه واکنشها در عالم واقع معمولا در نوعی محلول اتفاق میافتند، وقتی مدلسازی میکردند، مجبور بودند که واکنشها با محیط بیرونی را نادیده بگیرند. چرا که اگر دانشمندان میخواستند که کامپیوتر، حلال را نیز در محاسبه خود دخیل کند، برای رسیدن به جواب مجبور بودند چند دهه صبر کنند تا کامپیوترهای ابتدایی آن دوران، بتوانند محاسبات را انجام دهند.

در نتیجه، شیمی کلاسیک و کوانتوم بر مبانی کاملا متفاوتی بنا نهاده شده بودند، و از برخی جهات در دنیاهای جداگانه و متضادی سیر میکردند. ولی برندگان نوبل امسال شیمی دروازهای بین این دو دنیا باز کردند. در مدل کامپیوتری آنها، نیوتن و سیبش با شرودینگر و گربهاش دوست بودند.
همکاری شیمی کوانتوم با فیزیک کلاسیکاولین گام در این همکاری در ابتدای دهه 1970/1350 در آزمایشگاه مارتین کارپلاس در دانشگاه هاروارد امریکا برداشته شد. کارپلاس از دنیای کوانتوم میآمد. گروه پژوهشی او برنامههای کامپیوتری نوشته بودند که میتوانست واکنشهای شیمیایی را به کمک فیزیک کوانتوم شبیه سازی کند. او همچنین "معادله کارپلاس" را ارائه کرده بود، که در رزونانس مغناطیسی اتمی یا NMR از آن استفاده میشد؛ شیوه شناخته شدهای برای شیمیدانها که بر مبنای خواص شیمیایی کوانتومی مولکولها بنا شده است. آریه وارشل با پایان تحصیلات دکترایش در سال 1970/1349، وارد آزمایشگاه کارپلاس شد. او دکترایش را در انستیتوی علوم وایزمن گرفته بود. این دانشگاه یک کامپیوتر قدرتمند به نام گولم داشت. آریه وارشل و مایکل لویت به کمک گولم یک برنامه کامپیوتری بر مبنای نظریههای کلاسیک نوشته بودند. برنامه آنها اجازه شبیه سازی هر نوع مولکولی را میداد، حتی مولکولهای زیستی خیلی بزرگ.
هنگامی که آریه وارشل به مارتین کارپلاس در هاروارد پیوست، برنامه کامپیوتریش را هم با خود آورد. او و کارپلاس با استفاده از آن به عنوان نقطه عزیمت، شروع به نوشتن یک نوع برنامه جدید کردند که انواع محاسبات مختلف را بر روی الکترونها انجام میداد. در اکثر مولکولها هر الکترون به دور یک هسته اتمی مشخص میگردد. ولی در برخی مولکول ها، اتمهای مشخصی میتوانند آزادانه در فضای بین مولکولی حرکت کنند. چنین الکترونهای آزادی را مثلا میشود در مولکولهای شبکیه چشم یافت. کارپلاس از قدیم علاقه خاصی به مولکول رتینال (شبکیه) داشت، چرا که خواص شیمیایی این مولکول میتوانست بر یک عملکرد خاص زیستی تاثیر بگذارد؛ وقتی نور به رتینال برخورد میکند، الکترونهای آزاد رتینال پر از انرژی میشوند؛ که حالت مولکول را عوض میکند. این اولین گام در دیدن انسان است.
در نهایت کارپلاس و وارشل تصمیم به مدلسازی رتینال گرفتند. آنها با مولکولهای ساختاری مشابه اما سادهتر شروع کردند. سپس یک برنامه کامپیوتری نوشتند که وقتی محاسبات الکترونهای آزاد را انجام میداد، از فیزیک کوانتوم استفاده میکرد، و برای دیگر الکترونها و همه هستههای اتمها از فیزیک کلاسیک. آنها در سال 1972/1351 مقاله خود را منتشر کردند. این اولین باری بود که فردی یک همکاری شیمیایی بین فیزیک کلاسیک و کوانتوم ترتیب میداد. برنامه آنها راه جدیدی را گشوده بود، اما یک محدودیت داشت: تنها میتوانست مولکولهایی با شکل هندسی متقارن را شبیه سازی کند.
برنامه جامع محاسبه شیمی زندگیپس از دو سال در هاروارد، آریه وارشل دوباره با مایکل لویت همکار شد. لویت اکنون دکترایش را در کمبریج انگلیس تمام کرده بود؛ که در آن زمان دانشگاه پیشرو جهان در بررسی مولکولهای زیستی مانند دی.ان.ای، آر.ان.ای و پروتئینها بود. او از برنامه کامپیوتری کلاسیک خود استفاده کرده بود تا بتواند به درک بهتری از این برسد که مولکولهای زیستی چه شکلی هستند. ولی محدودیت به جای خود باقی مانده بود؛ این نرم افزار فقط میتوانست مولکولها را در حالت استراحت بررسی کند.
هدف لویت و وارشل بلند پروازانه بود، برنامهای که بشود از آن برای بررسی آنزیمها استفاده کرد؛ یعنی پروتئینهایی که واکنشهای شیمیایی را در اندامهای ما کنترل و ساده سازی میکنند. وارشل که در آن زمان دانشجویی جوان بود، در مورد نحوه عملکرد آنزیمها کنجکاو شده بود. این همکاری بین آنزیمها است که حیات را ممکن کرده است. آنها تقریبا کل فرایندهای شیمیایی در بدن ما را کنترل میکنند. اگر میخواهید حیات را درک کنید، باید سر از کار آنزیمها در بیاورید.
لویت و وارشل برای این که بتوانند واکنشهای آنزیمها را شبیه سازی کنند، باید در محیطی یکدستتر از هر دو نوع فیزیک کلاسیک و کوانتوم استفاده میکردند. سالها طول کشید تا بر همه موانع فائق بیایند. آنها کار خود را در انستیتو وایزمن شروع کردند، ولی وقتی چند سال بعد، لویت دوره پست دکترایش را تمام کرد، به کمبریج برگشت و وارشل هم به او پیوست. در سال 1976/1355، آنها به هدف خود رسیدند و مقاله اولین مدل کامپیوتری واکنش آنزیمها را منتشر کردند. برنامه آن دو انقلابی بود چون میشد از هر نوع مولکولی در آن استفاده کرد. ابعاد مولکول دیگر مانعی بر سر شبیه سازی واکنشهای شیمیایی نبود.
تمرکز بر روی قلب فرایندامروزه هنگامی که شیمیدانها فرایندهای شیمیایی را مدلسازی میکنند، نیرو را درست به جایی که مورد نیاز است اعمال میکنند. آنها محاسبات پرمصرف فیزیک کوانتوم را بر روی الکترونها و هستههای اتمی انجام میدهند که مستقیما در فرایند شیمیایی نقش دارند. به این ترتیب، آنها بیشترین دقت را در جایی که مورد نیاز است، به دست میآورند. دیگر بخشهای مولکولها با استفاده از معادلات کلاسیک مدل میشوند.
برای عدم اتلاف توان محاسباتی کامپیوتر، مایکل لویت و آریه وارشل، حذف شاخ و برگهای اضافی محاسبات را حتی یک مرحله جلوتر بردند. کامپیوتر همیشه مجبور نیست که تک تک اتمها را در بخشهای کم اهمیتتر مولکول در نظر بگیرد. آنها نشان دادند که میتوان چندین اتم را در جریان محاسبات با هم یکی کرد و از بار محاسبات کاست.
در معادلات امروزی، دانشمندان یک لایه سوم را هم به شبیهسازیهای خود افزودهاند. کامپیوتر در یک فرایند ساده سازی شده میتواند برای مناطقی که دور از فرایند شیمیایی قرار دارند، اتمها و مولکولها را به صورت یک جرم یکنواخت در نظر بگیرد. در جوامع علمی، به چنین چیزی رسانای دیالکتریک میگویند.
آینده شبیهسازیهااین واقعیت که دانشمندان امروزه میتوانند از کامپیوتر برای انجام آزمایشهای خود استفاده کنند، منجر به درک عمیقتری از نحوه انجام واکنشهای شیمیایی شده است. قدرت شیوههایی که مارتین کارپلاس، مایکل لویت و آریه وارشل خلق کردند، در این بود که این شیوهها جهانی و جامع بودند. میتوان از آنها برای بررسی هر نوع واکنش شیمیایی استفاده کرد؛ از مولکولهای زیستی تا فرایندهای شیمیایی صنعتی. دانشمندان می توانند سلولهای خورشیدی، کاتالیزورهای موتورهای خودروها یا حتی داروها را به کمک اینها بهینه کنند.
اما پیشرفت در اینجا متوقف نخواهد شد. مایکل لویت در یکی از نوشتههایش در مورد رویایش مینویسد: شبیه سازی اندامهای حیاتی در سطح مولکولی. ایده جذاب اما سهل و ممتنعی به نظر میرسد. مدلهای کامپیوتری که توسط برندگان جایزه نوبل 2013 شیمی ساخته شدهاند، ابزارهای قدرتمندی هستند. ولی دقیقا تا کجا می توانند دانش ما را به پیش ببرند، چیزی است که آینده در مورد آن تصمیم میگیرد.
برندگان جایزه نوبل شیمی 2013
 مارتین کارپلاس83 ساله. دکترای خود را در سال 1953/1332 از کلتک (انستیتو صنعتی کالیفرنیا) دریافت کرد. او استاد دانشگاه استراسبورگ فرانسه و استاد بازنشسته صاحب کرسی تئودور ویلیام ریچاردز در دانشگاه هاروارد است.
مارتین کارپلاس83 ساله. دکترای خود را در سال 1953/1332 از کلتک (انستیتو صنعتی کالیفرنیا) دریافت کرد. او استاد دانشگاه استراسبورگ فرانسه و استاد بازنشسته صاحب کرسی تئودور ویلیام ریچاردز در دانشگاه هاروارد است.
 مایکل لویت66 ساله. دکترای خود را در سال 1971/1350 از دانشگاه کمبریج انگلیس دریافت کرد و هماکنون استاد صاحب کرسی رابرت و ویویان سی کیهیل در مرکز تحقیقات سرطان، دانشکده پزشکی دانشگاه استنفورد امریکاست.
مایکل لویت66 ساله. دکترای خود را در سال 1971/1350 از دانشگاه کمبریج انگلیس دریافت کرد و هماکنون استاد صاحب کرسی رابرت و ویویان سی کیهیل در مرکز تحقیقات سرطان، دانشکده پزشکی دانشگاه استنفورد امریکاست.
 آریه وارشل73 ساله. دکترای خود را در سال 1348/1969 از انستیتوی علوم وایزمن رهووات دریافت کرد و هماکنون استاد ممتاز دانشگاه کالیفرنیای جنوبی است.
آریه وارشل73 ساله. دکترای خود را در سال 1348/1969 از انستیتوی علوم وایزمن رهووات دریافت کرد و هماکنون استاد ممتاز دانشگاه کالیفرنیای جنوبی است.
الکترونگاتیویته چیست؟
متداولترین مقیاس الکترونگاتیویته
مقیاس نسبی الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی б+ و б- اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق б و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد. در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد 4 نسبت داده شده است.
مقیاس الکترونگاتیوی پاولینگ ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوند است. مثلا انرژی پیوند Br-Br ، انرژی لازم برای تفکیک مولکول Br2 به اتمهای Br است. برای تفکیک یک مول از مولکولهای Br2 به اندازه 46+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر 104+ کیلو کالری بر مول است.
تعاریف مختلف الکترونگاتیویته
الکترونگاتیویته ، در روشهای متفاوتی تعریف شده است که برخی از آنها به اختصار توضیح داده میشود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B میتواند به حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B بطور قابل ملاحظه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد، میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد.
الکترونگاتیویته آلرد_روکر در این تعریف ، الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس میکند. بر طبق این تعریف ، عناصری با الکترونگاتیویته بالا آنهایی هستند که با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک ، این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توزیع دوباره الکترون در طی تشکیل تر کیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
اگر یک اتم دارای انرژی یونیزاسیون بالا و الکترونخواهی بالا باشد، احتمالا در هنگام تشکیل پیوند ، الکترونها را به سوی خود میکشد. بنابراین بعنوان الکترونگاتیو شناخته میشود. از طرف دیگر اگر انرژی یونش و الکترونخواهی آن ، هر دو کوچک باشد تمایل دارد تا الکترون از دست بدهد. بنابراین به عنوان الکترو پوزیتیو طبقه بندی میشود.
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی میکند.
تغییرات الکترونگاتیویته عناصر
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و همچنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد. فلزات ، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آنها حاکم است، ولی نافلزات ، به استثنای گازهای نجیب ، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آنها زیاد است.
بطور کلی ، الکترونگاتیوی عناصر در هر دوره از چپ به راست (با افزایش تعداد الکترونهای والانس) و در هر گروه از پایین به بالا (با کاهش اندازه اتم) افزایش مییابد. بنابراین ، الکترونگاتیوترین عناصر ، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات ، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی همجهت است.
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است، ولی دقیق نیست. روشی ساده و مستقم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روشهای گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتمهای متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم نامتغیر نیست.
انتظار میرود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از اینرو ، این مفهوم را تنها بایستی نیمهکمی تلقی کرد. بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی میشود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آنها خیلی زیاد نباشد. در اینگونه موارد، اختلاف الکترونگاتیوی عناصر نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است. اگر اختلاف الکترونگاتیوی صفر یا خیلی کوچک باشد، میتوان گفت که پیوند اساسا غیر قطبی است و اتمهای مربوط ، سهم مساوی یا تقریبا مساوی در الکترونهای پیوند دارند.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که HF قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل میشود، پیوند فلزی و در آن اختلاف الکترونگاتیوی نسبتا کم است.
کاربردهای الکترونگاتیویته
میتوان برای تعیین میزان واکنش پذیری فلزات و غیر فلزات بکار برد.
میتوان برای پیشبینی خصلت پیوندهای یک ترکیب بکار برد. هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود 1.7 باشد، خصلت یونی نسبی پیوند بیش از 50% است.
اگر اختلاف الکترونگاتیوی صفر و یا خیلی کوچک باشد، پیوند غیر قطبی است. هرچه اختلاف الکترونگاتیوی بیشتر باشد، پیوند کووالانسی قطبیتر خواهد بود. در این پیوندها ، اتمی که الکترونگاتیوی بیشتری دارد، بار منفی جزئی را خواهد داشت.
با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونی حاصل میشود. مثلا اختلاف الکترونگاتیوی سدیم و کلر 2.1 است و NaCl یک ترکیب یونی است.
آیا الکترونگاتیوی یک عنصر همیشه ثابت است؟
مفهوم الکترونگاتیوی غیر دقیق است. زیرا این خاصیت نه تنها به ساختمان اتم مورد بحث بستگی دارد، بلکه تعداد و ماهیت اتمهای دیگری که به اتم مزبور پیوند داده شدهاند نیز در آن دخالت دارد. بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
پیگمانها ـ رزینها ـ بایندرها و کاتالیستها در صنایع رنگ سازی
طور کلی از رنگ علاوه بر ایجاد زیبائی محیط، جهت حفاظت اشیاء در مقابل عوامل طبیعی و سببی از قبیل ضربه، خراش، سائیدگی، مواد شیمیائی، حلالها، آب و هوای جوی و غیره استفاده میگردد و بندرت دیده شده است که سطح یک جسم مورد دید را فقط با رنگ حفاظتی بپوشانند و از رنگ رویه تزئینی استفاده ننمایند.
صنعت رنگسازی قدمت طولانی دارد اوایل رنگ را بطریق ابتدائی از روغنهای گیاهی با استفاده از آسیابهای سنگی و دستی جهت نرم کردن رنگدانه ها تولید میکردند. اما امروزه با پیشرفت صنعت و تکنولوژی، صنعت رنگسازی پیشرفت شایانی نموده بطوریکه توانسته در میدان علم و صنعت جائی پرنفوذ برای خود باز نماید وبه جرات می توان گفت که یکی از ارکان مهم هر یک از تولیدات صنایع گوناگونی که به مصارف عمومی و یا خصوصی می رسند، می باشد.
بعضی از رنگها مثل آستریها بعلت داشتن مقدار زیادی پیگمان مات بوده که به منظور حفاظت از سطوح بکار میروند و برخی دیگر نیمه شفاف و شفاف می باشند که از آنان بر روی آستریها به هر دو منظور حفاظتی و تزئینی استفاده می گردد.
● خواص پیگمانها:
پیگمان در صنایع رنگسازی رل مهمی از قبیل ایجاد رنگ، پوشش، براقیت، سختی، مقاومت، حفاظت ، افزایش چسبندگی، و غیره را ایفا مینماید که در آستریها و رنگهای رویه مصارف بسیار دارد
ـ آستری:
عملکرد اصلی آن بیشتر در حفاظت از یک سطح است تا تزیین آن عملاً مات بوده و درصد پیگمان آن نیز خیلی زیاد است. هدف اصلی استفاده از یک آستری، صاف و یکنواخت نمودن سطوح و حفاظت آنان در مقابل زنگ زدگی میباشد. بتونه ها، سیلرها و آستریها همگی از یک خانواده اند.
ـ سیلر:
فی مابین آستری و رنگ رویه جهت افزایش چسبندگی بهتر و بیشتر آستری و رنگ رویه و همچنین افزایش ضخامت فیلم بکار میرود.
ـ رنگ رویه:
ادامه مطلب ...تولید چسب صنعتی
پخت یا پروراندن رزین چسب به صورت یک جسم جامد اپوکسیها معروفترین چسبهای این گروه هستند که با استفاده از رزینهای سیکلوآلیفاتیک ، طوری فرمولبندی میشوند که در دماهای بالا قابل استفاده باشند. برای سنتز چسبهای قوی و نیمه انعطافپذیر از رزینهای اپوکسی با عوامل پخت پلی آمین یا پلی آمید استفاده میشود و بیشتر اپوکسیها بدون استفاده از مواد افزودنی هم چسبندگی خوبی دارند. زمان پخت میتواند از ثانیهها تا روزها طول بکشد که این امر به کاتالیزورها و دما بستگی دارد. اپوکسی فنولی با استفاده از این چسبها میتوان اتصالاتی پدید آورد که تا 315ºC پایدار هستند. این چسبها در دماهای بالا پرورده میشوند و از آنها برای پیوند ساختمانی و لانه زنبوری استفاده میشود. از دیگر چسبهای این گروه میتوان از پلی استرها (که ارزان قیمت و زودگیر و شکننده هستند)، سیلیکونها ، سیانوآکریلاتها و آکریلیها ، نام برد. تبخیر حلال از محلول پلیمر گرمانرم
چسبهای بسیاری برای متصل کردن اجسام مشابه یا غیر مشابه در دسترس هستند. امروزه تقریبا استفاده از چسبانندههای طبیعی مثل سریش بجز موارد استفاده خاصی منسوخ شده است. در عوض هر روز شاهد تولید و سنتز چسبهای جدیدی هستیم که منشأ پلیمری دارند. چسبها در اشل صنعتی به شیوههای گوناگونی تهیه میشوند که در این بحث برخی از مهمترین روشها را معرفی میکنیم.
ادامه مطلب ...اندازه گیری قلیائیت :
مواد مورد نیاز :
1- متیل اورانژ :
5/0 گرم متیل اورانژ را در یک لیتر آب مقطر حل کنید.
2- فنل فتالئین :
5/0 گرم فنل فتالئین ( Phenol Phetalein disodium salt) را در cc 50 الکل اتیلیک حل نموده و با آب مقطر به حجم cc 100 برسانید. قطره قطره سود نرمال بآن بیفزائید تا رنگ صورتی ظاهر شود.
3- H2SO4 02/0 نرمال :
5/0 H2SO4 را با آب مقطر به حجم cc 500 برسانید.
روش آزمایش:
1-cc 50 از آب مورد آزمایش را در ارلن مایر بریزید.
2- 3 قطره فنل فتالئین اضافه کنید اگر رنگ کلی شد آب دارای قلیائیت فنل فتالئین است که باید با H2SO4 02/0 نرمال تیتر شود.
3- بعد از اندازه گیری قلیائیت فنل فتالئین به همان محلول 3 قطره متیل اورانژ بیافزایید.
4- با محلول H2SO4 02/0 نرمال تیتر کنید تا رنگ پوست پیازی ظاهر شود.
20 * = V H2SO4 0.02 N ppm قلیائیت
ضد یخ ها
ضد یخ ها
ضد یخ ها موادی هستند که در سیستم های خنک کننده و در رادیاتورهای موتورهای احتراق داخلی جهت حصول اطمینان از جریان داشتن مایع در درجات کم حرارتی به منظور جلوگیری از خسارت ناشی از تشکیل یخ به کار برده می شود .
شرایط لازم عبارت از این هستند که ماده مرکبه باید نقطه انجمادی کمتر از نقطه انجماد مورد وقوع احتمالی باشد بدون اینکه نقظه جوش را از نقطه جوش اب زیاد پایین بیاورد نباید فلزات را بخورد یا اینکه اتصالات لاستیکی را ضایع کند باید تا نقطه جوش مربوطه پایدار بوده و از لحاظ تجاری در دسترس باشد.
قبلا کلرو کلسیم برای رادیاتور اتومبیل ها به کاربرده می شد که خوردگی ایجاد می کرد این جسم هنوز در مخازن اتش نشانی به کار برده می شود . ولی نقطه جوش زیاد ان امکان گرم شدن بیش از حد موتور را به وجود می اورد به علاوه روغن های لاستیک را نرم میکند. الکل اتیلیک ( اتانول – الکل تقلبی ) نیز ممکن است به کار برده شود ولی متانول کمتر خورنده بوده و ارزانتر است. یک محلول 30 درصد الکل اتیلیک در اب دارای نقطه انجمادی حدود 15- درجه سانتیگراد و محلول 50 درصد ان حدود 32- درجه سانتیگراد است به هر صورت الکل باید به علت اتلاف ان بر اثر تبخیر مکرر تجدید شود.
گلیسیرول ( گلیسرین ) نیز به عنوان ماده ضد یخ به کار برده می شود محلول 40 درصد ان در اب نقطه انجماد را تا 17.5- درجه سانتیگراد و محلول 50 درصد ان تا 26- درجه سانتیگراد پایین می اورد از معایب ان لزج بودن را میتوان نام برد ولی به اسانی تبخیر نمی شود.
اتیلن گلیکول نقطه انجماد را به میزان بیشتری از الکل پایین می اورد و دارای نقطه جوش زیادی است . به طوری که بر اثر تبخیر از بین نمی رودو اتصالات لاستیکی را نیز نرم نمیکند ولی قیمت مواد اولیه ان بیشتر است .
مواد ضد یخ با اسامی تجاری مختلفی وجود دارند که عموما بر مبنای اتیلن گلیکول و گاه بر مبنای متانول ساخته شده اند. مواد دیگری نظیر گلیسرین یا پروپانول نیز به انها برای جلوگیری از کف کردن و تشکیل خلط افزوده می شود. صرف نظر از رادیاتورهای موتورهای احتراقی مخلوطی از مواد مختلف با اب در نسبت های معین درجه انجماد محلول را تا حد زیادی پایین می اورد که از این مخلوط ها برای مقاصد مختلف استفاده می شود.
مایعات ضد یخ
از محلول 20 تا 25 درصد گلیسرین در اب می توان به عنوان ضد یخ در رادیاتور اتومبیل استفاده نمود.
با استفاده از محلول الکل صنعتی و یا اتیلن گلیکول نیز می توان ضد یخ تهیه نمود .
منبع :
فرهنگ جامع فرمولها و فراورده های صنعتی
ترجمه و اقتباس : دکتر تقی قفقازی , مهندس مهران بختی و بشیر بختی
آب تبلور به چه معناست؟
آب تبلور به چه معناست؟
آب تبلور آبی است که به همراه مولکولهای بعضی بلورهای جامدهای یونی است. هنگامی که یک جامد یونی از محلول آبی متبلور می شود به عنوان مثال باریم کلرید محلول در آب است و ما به وسیلهی تبخیر یک مقدار از محلول و اشباع کردن محلول، مقداری بلور BaCl2 به دست می آوریم. در این هنگام تعدادی از مولکولهای آب در شبکه بلور به دام افتاده و با بلور پیوندهای ضعیف واندروالسی برقرار می کند. در این هنگام ما به جای BaCl2 خالص، نمک متبلور آن را داریم و فرمول آن به صورت ((BaCl2, 2H2O(s) می باشد. به این گونه بلورهای نمکی که با مولکولهای آب همراه هستند، هیدرات و به آبی که این بلورها را همراهی می کند و در شبکه ی بلوری این نمکها وارد شده است، آب تبلور گفته می شود. مثال دیگر از این دست، سولفات مس هیدراته است که دارای 5 مولکول آب تبلور می باشد:( (CuSO4, 5H2O (s)
معمولا ً ظاهر هیدراتها با ترکیبات بی آب آنها کاملا ً تفاوت دارد. به طور معمول، هیدراتها بلورهای نسبتا ً بزرگ و غالبا ً شفاف تشکیل می دهند. هیدراتها بر اثر گرم شدن تجزیه می شوند و آب تبلور خود را به صورت بخار آب از دست می دهند.
BaCl2, 2H2O(s) à BaCl2 (s) + 2H2O(g(
از بین رفتن آب تبلور یک هیدرات را شکوفا شدن می نامند.
ادامه مطلب ...قوانین در عدد اکسایش
عدد اکسایش، عده ی بارهای مربوط به اتمهای ترکیب بر اساس برخی قواعد اختیاری است.
عدد اکسایش یک یون یک تک اتمی برابر با بار آن یون می باشد. مثلا در NaCl، عدد اکسایش سدیم در +Na برابر ۱+ و عدد اکسایش کلر در -Cl برابر ۱- است.
عدد اکسایش اتمها در یک مولکول کووالانسی را می توان با دادن الکترونهای هر پیوند به اتم الکترونگاتیو تر به دست آورد.
قانون شماره 1:عدد اکسایش یک اتم در شکل اصلی (عنصری) همیشه صفر است.
ماده عنصری است که شامل گزینه های زیر باشد:
الف: فقط یک نوع اتم وجود داشته باشد.
ب:بار=0
مثال:
S8: عدد اکسیداسیون ـــــ>>> S = 0
Fe: عدد اکسیداسیون ـــــ>>> Fe = 0
قانون شماره2
تقارن در شیمی
تقارن در شیمی زمینه حل بسیاری از مسائل علم شیمی مانند: ساختار ملکول.ساختار الکترون.
تشکیل پیوند و هیبریداسیون همچنین پیش بینی طیف زیر قرمز را فراهم میکند.
در اینجا به بررسی تقارن ملکولهای مجزا میپردازیم که تقارن آنها به تقارن نقطه ای موسوم است.
مفاهیم مهم در تقارن
1-عنصر تقارن: واقعیتی هندسی مانند خط صفحه و یا نقطه که یک یا چند عمل تقارن نسبت به
آن انجام میشود.
2-عمل تقارن: حرکت یا عملی که انجام آن روی ملکول یا سیستم وضعیت جدیدی ایجاد کند طوری
که وضعیت جدید از وضعیت قبلی ملکول یا سیستم غیر قابل تمییز باشد.
پس وضعیت جدید شبیه به وضعیت قبلیست اما معادل با آن نیست.
در تقارن این دو مفهوم به نحو جدایی ناپذیری به هم مربوط اند.چون عمل تقارنی فقط به پشتوانه یک
عنصر تقارن انجام میشود و به همین ترتیب وجود عنصر تقارن تنها زمانی برای سیستم اهمیت دارد
که بتوان روی آن یک عمل تقارنی انجام داد.
5 نوع عنصر تقارن و عمل تقارنی برای مشخص کردن تقارن ملکولی:
ساخت نانوکامپوزیت بر پایه گرافن برای جذب آلایندههای آب

پژوهشگران ایرانی با سنتز نانوذرات سریم اکساید-تیتانیم دیکساید و تهیه نانو کامپوزیت سریم اکساید-تیتانیم دی اکساید، توانستند به اندازه ذرات کوچکتر و مساحت سطح بالاتر و در نتیجه تعداد سایتهای فعال بیشتر برای جذب آلایندهها دست پیدا کنند. این امر باعث افزایش بازده جذب آلایندهها در تصفیه آب شده و در حل مشکلات موجود در تصفیه پسابهای حاصل از صنایع نساجی کمک بسزایی میکند.
ادامه مطلب ...شناسایی کاتیون ها
1- اثر محلول کلریدریک اسید رقیق: با کلریدریک اسید ، رسوب سفید سرب کلرید تولید می شود که در سرما در آب غیر محلول است:
Pb(NO3)2 + 2HCl --> PbCl2 + 2HNO3
2- اثر محلول پتاسیم یدید: رسوب زردرنگ سرب یدید در حضور مقدار اضافی پتاسیم یدید تولید می گردد.
Pb(NO3)2 + 2KI --> PbI2 + 2KNO3
3- اثر سولفوریک اسید رقیق: رسوب سفید رنگ PbSO4 در حضور اضافی معرف تولید می گردد.
Pb(NO3)2 + H2SO4 --> PbSO4 + 2HNO3
4- اثر پتاسیم کرومات: رسوب زردرنگ سرب کرومات تولید می شود:
Pb(NO3)2 + K2CrO4 --> PbCrO4 + 2KNO3
کاتیون قلع Sn می تواند حالت های اکسایش 2 یا 4 داشته باشد و شناسایی این دو یون به طرق مختلفی صورت می گیرد:
برای بررسی کاتیون Sn2+ از محلول قلع IIکلرید SnCl2 استفاده می شود. دو روش ان در زیر آمده است:
1- اثر H2S . رسوب قهوه ای رنگ قلع سولفید از محلولی که زیاد اسیدی نباشد، بدست می آید:
SnCl2 + H2S --> SnS + 2HCl
2- اثر سدیم هیدروکسید یا پتاسیم هیدروکسید: در حضور اندک مقدار باز، رسوب سفید رنگ قلع هیدروکسید پدید می آید:
SnCl2 + 2NaOH --> Sn(OH)2 + 2NaCl
شناسایی کاتیون Sn4+:
برای بررسی این واکنشها از محلول قلع IV کلرید استفاده شده است:
اثر H2S . رسوب زرد رنگ قلعIV سولفید از محلولی که زیاد اسیدی نباشد یا در محیط اسیدی رقیق، بدست می آید:
SnCl4+ 2 H2S --> SnS2 + 4HCl
* شناسایی آنیونها
برای شناسایی آنیونها از انواع شناساگرها استفاده می شود. هر کدام از آنیونها معرف خاص خود را دارد. به عنوان مثال برای شناسایی یون کلرید، کمی از محلول حاوی یون کلرید را در لوله ی ازمایش می ریزند و به آن یک قطره محلول نقره نیترات می افزایند. رسوب سفید تشکیل شده AgCl معرف حضور یون کلرید در محلول می باشد.
همچنین افزایش نقره نیترات به محلول حاوی یون برمید Br-، رسوب زرد رنگ AgBr را به وجود می آورد که معرف حضور یون برمید در محلول اولیه بوده است.
استخراج مداوم به وسیله سوکسله

دستگاه آزمایشگاهی است که در سال 1879 توسط فرانتس فون سوکسلت (Franz von Soxhlet) اختراع شد. این روش در اصل برای استخراج چربی از مواد جامد طراحی شده بود. با این حال، کاربرد سوکسله به استخراج لیپیدها محدود نشده است. نمونه در مخزن سوکسله (Soxhlet Thimble) ریخته می شود، و یک حلال مورد نظر در بالن ریخته می شود که در اثر حرارت حلال بخار شده و روی نمونه ریخته می شود این چرخه وقتی که مخزن سوکسله پر شد از طریق سیفون نازک شیشه ای دوباره به بالن بر می گردد و به این ترتیب این چرخه انجام می شود.
ادامه مطلب ...مروری بر جوهرهای چاپ بر پایه رزین های اکریلیکی آب پایه
- مقدمه
قبل از اواسط دهه 1970 ، رزین¬های بر پایه روزین فوماریت (مانند نمک های سدیم و آمین روزین) اصلی¬ترین رزین¬های مورد استفاده در جوهرهای آب پایه بودند، خواص این رزین¬های محلول روزین آب پایه کاملاً مشابه خواص رزین¬های فنولیک روزین و مالئیک روزین پنتا¬اریتریتول¬استرهای مورد استفاده در جوهرهای چاپ لیتوگرافی بود. این دسته از رزین¬ها به دلیل قیمت کم، خاصیت ذاتی پراکنش رنگدانه و قابلیت اصلاح گرانروی و سختی به میزان دلخواه، تا زمان بوجود آمدن چاپ لترپرس مورد استفاده قرار می¬گرفتند. ولیکن با جایگزینی چاپ گراور و فلکسوگرافی آبی به جای سیستم¬های حلالی، این رزین-ها قادر به برآوردن نیازهای سیستم های جدید نبودند.
جهت دستیابی به محدوده گسترده خواص و گرانروی، استفاده از پلیمرهای امولسیونی رواج پیدا کرده¬است. زیرا از یک سو گرانروی کم آن¬ها استفاده از آن¬ها را در جوهرهای چاپ گراور و فلکسو میسر می¬ساخت و از سوی دیگر با تغییر وزن مولکولی، دمای انتقال¬شیشه¬ای و توزیع اندازه ذرات، امکان دستیابی به خواص مختلف جوهر تولیدی فراهم می¬شد. در نتیجه استفاده از پلیمرهای امولسیونی در ساخت جوهرهای چاپ گراور و فلکسوگرافی جهت چاپ بر روی بسته¬ها، کارتن¬های کاغذی، جعبه¬ها، پاکت¬ها، روزنامه¬ها و دیگر زیرآیندهای منعطف و محصولات کاغذی رواج پیدا کرد. لازم به یادآوری است که موارد مهم در طراحی پلیمرهای امولسیونی مورد استفاده در جوهرهای چاپ پایداری پراکنش رنگدانه¬ها، تشکیل فیلم در دمای محیط و انحلال¬پذیری مجدد جوهر می¬باشد که در بسیاری از انواع امولسیون جوهرها، رزین کمکی این وظیفه را بر عهده دارد. این رزین تا 60 درصد جامد امولسیون را تشکیل می¬دهد و تا 90 درصد نیاز به مواد سطح فعال و پایدارکننده را کاهش می دهد.
2- انواع جوهر
شیمی معدنی
در شیمی معدنی در مورد گستره وسیعی از موضوعات از جمله: ساختمان اتمی، بلورنگاری (کریستالوگرافی)، انواع پیوندهای شیمیایی اعم از پیوندهای کووالانسی، یونی، هیدروژنی و ...، ترکیبات کوئوردیناسیون و نظریههای مربوطه از جمله نظریه میدان بلور و نظریه اوربیتال مولکولی، واکنشهای اسید و باز، سرامیکها، تقارن مولکولی و انواع بخشهای زیرطبقه الکتروشیمی (برقکافت، باطری، خوردگی، نیمه رسانایی و غیره) بحث میشود.
در باب اهمیت شیمی معدنی، ساندرسن چنین نوشته است:
ادامه مطلب ...ذرات زیر اتمی
هادرون – باریون – بوزون – فرمیون – لپتون – بوزون های شاخص – گلوئن – نوترینوها – موئون – مزون – کوارک – پیون و ....
هادرون ها (Hadrons): ذرات زیراتمی ای هستند که از فرمیون هایی چون کوارک و آنتی کوارک و بوزون هایی چون گلوئن تشکیل شده اند.
این ذرات نیروی قوی هسته ای اعمال می کنند. هادرون ها مانند دیگر ذرات دارای عدد کوانتومی هستند. این ذرات ممکن است در دما یا فشار بسیار پایین خودبه خود از بین بروند.
باریون (Baryon): ذراتی هستند که از کوارک تشکیل شده اند. برای مثال پروتون از دو کوارک بالا (u) و یک کوارک پایین (d) تشکیل شده و یا نوترون از دو کوارک پایین و یک کوارک بالا تشکیل شده.
انواع باریون طبق مدل استاندارد (SM) به صورت زیر است:
ادامه مطلب ...اعداد کوانتومی مغناطیسی مداری
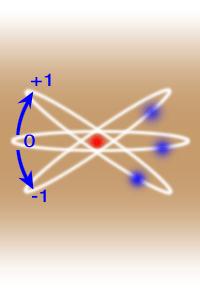
الکترون در اثر نیرویی که از طرف هسته بر آن وارد میشود، حول هسته میچرخد. چون الکترون یک ذره باردار است، بنابراین مدار الکترون را میتوان یک مدار مغناطیسی در نظر گرفت. برای این مدار مغناطیسی و در واقع برای الکترون میتوان یک گشتاور دو قطبی مغناطیسی تعریف نمود. این کمیت بر اساس اندازه حرکت زاویهای مداری الکترون تعریف میشود. یعنی از رابطه μ = eL/2m حاصل میشود که در آن μ گشتاور دو قطبی مغناطیسی است.
حال اگر یک میدان مغناطیسی خارجی اعمال شود،
منعقد کننده های پلیمری آلی
منعقد کننده های پلیمری آلی
خلاصه:
به منظور تسریع در ته نشینی مواد معلق در آب خام ، کاهش و حذف کدورت آب از منعقد کننده های معدنی و آلی بطور جداگانه یا تواماً استفاده می شود . منعقد کننده های معدنی نمکهای فلزات آلومینیوم و آهن مانند کلرورفریک ، سولفات آهن ، سولفات آلومینیوم و دیگر ترکیبات شیمیایی مشابه هستند که بطور وسیع در جداسازی مواد معلق ، زلالسازی آب خام و تصفیه پساب بکار برده می شوند . با توجه به محدود بودن محدودة دامنة فعالیت منعقد کننده های اصلی و به منظور بالا بردن راندمان فرآیند و کاهش قابل ملاحظة کدورت ، پلی مر های پلی آکریل آمید بعنوان کمک منعقد کننده یا منعقد کننده مستقل استفاده میگردند .

