شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.شیمی - بازرسی فنی
وبلاگ هر هفته یک حدیث به آدرس www.hadis89.blogsky.com منتظر مشتاقان احادیث پیامبر و ائمه معصومین (ع) می باشد.مصارف و کاربردهای زئولیت ها
بیش از دو هزار سال است که زئولیت ها در زندگی روزمزه انسان مورد استفاده قرار می گیرد(Mumpton, 1981). در سال های اخیر به موارد کاربرد زئولیت های طبیعی اهمیت خاص داده شده است و برنامه هایی برای استفاده از زئولیت های رسوبی در بسیاری از کارهای صنعتی و کشاورزی دردست اقدام است. توف های زئولیتی آبگیری شده به عنوان جذب کننده برای خروج نیتروژن آمونیاکی از آب های آلوده خارج شده از کارخانه ها به استخرهای پرورش ماهی و فاضلاب ها به کار می رود. زئولیت ها علاوه بر اینکه به عنوان مصالح ساختمانی سبک مورد استفاده قرار می گیرند بلکه در سیمان های پوزولانی و سرامیک مصرف می شوند. علاوه بر این ها زئولیت ها در صنایع کاغذ سازی به جای کائولن(Kuzvant,1984)، در محل های کشاورزی، در دامداری و در صنعت مواد کاربرد زیادی دارد.
الف- کنترل آلودگی :
الف – 1 – مدفون کردن یا تجزیه و تخریب زباله های رادیو اکتیو :
طیف سنجی رامان
خلاصه:
طیفسنجی رامان برای شناسایی ساختار مولکولی بسیار مناسب است با این روش تعیین فرکانسهای چرخشی و ارتعاشی مولکول، ارزیابی هندسی و حتی تقارن مولکولها امکان پذیر است. در برخی موارد که امکان تعیین ساختار مولکولی وجود ندارد، میتوان با تکیه بر فرکانسهای ثبت شده، قرار گرفتن اتمها در یک مولکول را بررسی کرد. اطلاعاتی که توسط طیف سنجی مادون قرمز و رامان به دست میآید، بسیار مشابه هستند. به تازگی ساختار پیچیده مولکولهای زیستی با طیف سنجی رامان تعیین شده است. طیف رامان اطلاعات با ارزشی را نیز در زمینه فیزیک حالت جامد ارائه میکند.
ادامه مطلب ...دنیای کریستالها در شیمی
Amethyst

Borax

Aragonite

Copper Sulfate

Quartz

برای دیدن کریستالهای بیشتر به این آدرس مراجعه فرمایید.
سختی آب و اثرات آن
سختی آب و اثرات آن
آب سخت
آب سخت آبی است که حاوی نمکهای معدنی از قبیل ترکیبات کربناتهای هیدروژنی ٬ کلسیم ٬ منیزیم و... است.
اهمیت سختی آب
مقدار سختی آب ، علاوه بر اینکه در آبهای صنعتی اهمیت وافر دارد، از نظر بهداشت عمومی نیز اهمیت خاصی دارد. کلسیم که یکی از عوامل سختی آب است، در رشد استخوان و حفظ تعادل بدن دخالت داشته، ولی به همان اندازه ، سولفات کلسیم به علت کمی قابلیت هضم ، ناراحتیهایی در دستگاه هاضمه بوجود میآورد.
گاهی توصیه میشود که جهت تامین بهداشت و سلامت مصرف کنندگان ، آهک به آب آشامیدنی افزوده شود. بعضی دانشمندان معتقدند، بهتر است کلسیم و منیزیم لازم بدن توسط غذا تامین شود و حتیالامکان از آبهای سبک برای شرب استفاده شود. باید توجه داشت که بدن نسبت به سنگینی موجود در آب مورد مصرف خود حساسیت دارد، چنانچه این نوشیدنی تغییر یابد، ممکن است در دستگاه گوارش ایجاد اخلال نماید و این موضوع را به اصطلاح آب به آب شدن میگویند.
املاح محلول در آب و اثرات آنها
املاح موثر در تولید سختی :
Mg(OH)2, MgCO3, MgHCO3, Mg(NO3)2, MgCl2, MgSO4, Ca(OH)2, CaCO3, CaHCO3, Ca(NO3), CaCl2, CaSO4
املاح غیر تاثیر گذار در سختی:
K2SO4, KCl, KNO3, Na2SO4, NaCl, NaNO3
تاثیر قلیائیت در سختی آب
اگر قلیائیت کل آب ، مساوی یا بیشتر از سختی کل باشد، تمام سختی آب به صورت سختی کربناتی خواهد بود. در صورتی که که قلیائیت کل ، کمتر از سختی باشد، سختی کربناتی آب معادل قلیائیت بوده و سختی دائم ، اختلاف بین سختی کل و قلیائیت است.
واحدهای بکار رفته در سختی آب
در صورتی که مقادیر کاتیونهای مختلف برحسب میلی گرم بر لیتر (ppm) در دست باشد، معمولا جهت سهولت ، به کمک فاکتورهایی که از تقسیم وزن مولکولی کربنات کلسیم به وزن اتمی هر یک از عناصر بدست آمده ، کلیه این مقادیر برحسب کربنات کلسیم محاسبه و بیان میگردد. سختی آب ، معمولا بر حسب ppm یعنی mg/lit بیان میشود. علاوه بر این ، واحدهای آلمانی ، انگلیسی ، فرانسوی ، آمریکایی را نیز در بیان آن بکار میبرند؛
هر یک از درجات فوق به ترتیب برابر 17.9 و 14.3 و 10 و 17.2 میلی گرم در لیتر کربنات کلسیم است.
اندازه گیری سختی آب
اصول طیف سنجی جرمی
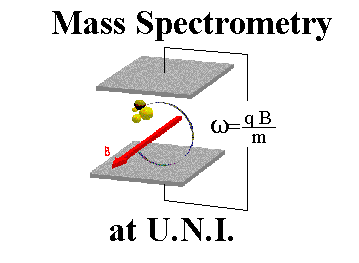
اصول طیف سنجی جرمی
به بیان ساده ، طیف سنج جرمی سه عمل اساسی را انجام میدهد:
مولکولها توسط جرایاناتی از الکترونهای پرانرژی بمباران شده و بعضی از مولکولها به یونهای مربوطه تبدیل میگردند. سپس یونها در یک میدان الکتریکی شتاب داده میشوند.
یونهای شتاب داده شده بسته به نسبت بار/جرم آنها در یک میدان مغناطیسی یا الکتریکی جدا میگردند.
یونهای دارای نسبت بار/جرم مشخص و معین توسط بخشی از دستگاه که در اثر برخورد یونها به آن ، قادر به شمارش آنها است، آشکار میگردند. نتایج داده شده خروجی توسط آشکار کننده بزرگ شده و به ثبات داده میشوند. علامت یا نقشی که از ثبات حاصل میگردد یک طیف جرمی است، نموداری از تعداد ذرات آشکار شده بر حسب تابعی از نسبت بار/جرم.
دستگاه طیف سنج جرمی
هنگامی که هر یک از عملیات را بدقت مورد بررسی قرار دهیم، خواهیم دید که طیف سنج جرمی واقعا پیچیدهتر از آن چیزی است که در بالا شرح داده شد.
سیستم ورودی نمونه
موازنه واکنشهای اکسایش- کاهش
دو روش برای موازنه واکنشهای اکسایش- کاهش بکار برده میشود: روش یون- الکترون و روش عدد اکسایش.
روش یون- الکترون برای موازنه معادلات اکسایش- کاهش
در موازنه معادلات به روش یون- الکترون ، دو دستور کار که کمی با هم متفاوتاند، مورد استفاده قرار میگیرد. یکی برای واکنشهایی که در محلول اسیدی انجام میگیرد و دیگری برای واکنشهایی که در محلول قلیایی صورت میپذیرد.
• مثالی برای واکنشهایی که در محلول اسیدی رخ میدهد، عبارت است:
Cr2O7-2 + Cl- → Cr+3 + Cl2
این واکنش موازنه نشده ، طی عملیات زیر موازنه می شود:
_ابتدا معادله را به صورت دو معادله جزئی که یکی برای نشان دادن اکسایش و دیگری برای نشان دادن کاهش است، تقسیم کرده و عنصر مرکزی را در هر یک از این نیم واکنش ها موازنه می کنیم:
Cr2O7-2 → 2Cr+3
2Cl- → Cl2
_اتمهای O و H را موازنه میکنیم. در سمتی که کمبود اکسیژن دارد، به ازای هر اکسیژن یک H2O اضافه میکنیم و در سمتی که کمبود هیدروژن دیده میشود، با افزودن تعداد مناسب +H آن را جبران می کنیم. در مثال بالا، طرف راست ، معادله جزئی اول 7 اتم اکسیژن کم دارد، پس به طرف مزبور 7H2O افزوده میشود. پس اتمهای H معادله جزئی اول را با اضافه کردن چهارده +H به طرف چپ معادله، موازنه میکنیم. معادله جزئی دوم ، بصورت نوشته شده ، از لحاظ جرمی ، موازنه است:
14H+ + Cr2O7-2 → 2Cr+3 + 7H2O
2Cl-→Cl2
_در مرحله بعد ، باید معادلات جزئی را از نظر بار الکتریکی موازنه میکنیم. در معادله جزئی جمع جبری بار الکتریکی طرف چپ برابر +12 و در طرف راست +6 است. 6 الکترون به سمت چپ اضافه میشود تا موازنه بار برای معادله جزئی اول حاصل شود. معادله دوم با افزودن دو الکترون به طرف راست ان موازنه میشود، ولی چون تعداد الکترونهای از دسترفته در یک معادله جزئی باید برابر تعداد الکترونهای بدست آمده در معادله جزئی دیگر باشد، بنابراین طرفین معادله جزئی دوم را در 3 ضرب میکنیم:
6e- + 14H+ +Cr2O7-2 → 2Cr+3 + 7H2O
6Cl- → 3Cl2 + 6e
_معادله نهایی ، با افزایش دو معادله جزئی و حذف الکترونها بدست میآید:
14H+ + Cr2O7-2 + 6Cl- → 2Cr+3 + 3Cl2 + 7H2O
• مثالی برای واکنش هایی که در محلول قلیایی صورت میگیرد:
MnO4- + N2H4 → MnO2 + N2
_معادله به دو معادله جزئی تقسیم می شود:
MnO4- → MnO2
N2H4→N2
_برای موازنه H و O در این واکنشها ، درسمتی که کمبود اکسیژن دارد، به ازای هر اتم اکسیژن -2OH و سمت دیگر یک H2O اضافه میکنیم و در سمتی که کمبود هیدروژن دارد به ازای هر اتم هیدروژن ، یک H2O و در سمت مقابل یک -OH اضافه میکنیم. سمت راست معادله جزئی اول دو اتم O کم دارد. لذا -4OH به سمت راست و 2H2Oبه سمت چپ میافزاییم:
2H2O + MnO4- → MnO2 + 4OH
برای موازنه جرمی معادله جزئی دوم ، باید چهار اتم هیدروژن به سمت راست اضافه کنیم، لذا 4H2O به سمت راست و -4OH به سمت چپ اضافه میکنیم:
-4OH + N2H4 → N2 + 4H2O
_برای موازنه بار الکتریکی ، هر جا لازم است، الکترون اضافه میکنیم و در این جا بطرف چپ معادله جزئی اول ، سه الکترون و بطرف چپ معادله جزئی دوم ، چهار الکترون افزوده میشود و برای موازنه کردن الکترونهای بدست آمده و از دست رفته ، مضرب مشترک گرفته و معادله اول را در 4 و معادله دوم را در 3 ، ضرب میکنیم:
12e- + 8H2 + 4MnO4- → 4MnO2 + 16OH
_جمع دو معادله جزئی، معادله نهایی را بدست میدهد:
4MnO4- + 3N2H4 →4OH- + 4MnO2 + 3N2 + 4H2O
روش عدد اکسایش برای موازنه واکنشهای اکسایش- کاهش
موازنه شامل سه مرحله است. برای مثال واکنش نیتریک اسید و هیدروژن سولفید را در نظر میگیریم. معادله موازنه نشده به قرار زیر است:
HNO3 + H2S→ NO + S + H2O
_برای تشخیص اتمهایی که کاهیده یا اکسیده میشوند، اعداد اکسایش آنها را از معادله بدست میآوریم:
نیتروژن کاهیده شده (از +5 به +2 ، کاهشی معادل 3 در عدد اکسایش) و گوگرد اکسید شده است (از -2 به صفر ، یعنی افززایشی معادل 2 در عدد اکسایش).
_برای ان که مجموع کاهش در اعداد اکسایش برابر با مجموع افزایش این اعداد باشد، ضرایبی متناسب به هر ترکیب نسبت میدهیم:
2HNO3 + 3H2S→2NO + 3S +H2O
_موازنه معادله را ، با بررسی دقیقتر ، کامل میکنیم. در مراحل پیشین تنها موازنه موادی مطرح شد که اعداد اکسایش انها تغییر میکند. در این مثال ، هنوز ضریبی برای H2O در نظر گرفته نشده است. ولی ملاحظه میشود که در سمت چپ واکنش 8 اتم H وجود دارد. همان سمت 4 اتم O نیز اضافی دارد. بنابراین ، برای تکمیل موازنه ، باید در سمت راست معادله ، 4H2O نشان داده شود:
2HNO3 + 3H2S → 2NO +3S + 4H2O
پس معادلات اکسایش- کاهش مانند واکنشهای الکتروشیمیایی و واکنش های یونی را میتوان با یکی از دو روش نامبرده موازنه کرد.
قلیائیت
قلیائیت به مقدار یونهایی که در آب وجود دارند و برای خنثی کردن یونهای هیدروژن در واکنش شرکت می کنند، اطلاق می شود. بدین ترتیب قلیائیت معیاری برای توانایی آب جهت خنثی سازی اسیدها به حساب می آید.
اجزای تشکیل دهنده قلیائیت در جدول زیر آمده است. این ترکیبات از تجزیه مواد معدنی موجود در خاک بوجود می آیند. فسفات می تواند از شویندها در خروجی فاضلابها، از کودهای شیمیایی و حشره کشها در زمین کشاورزی نیز بدست آید. سولفید هیدروژن و آمونیاک می تواند محصولات تجزیه میکروبی مواد آلی باشند.
HS- | HPO4-2 | HSiO3- |
HCO3- | NH3 | H2PO4- |
H2BO3- | OH- | CO3-2 |
معروفترین اجزای قلیائیت به ترتیب اهمیت عبارتند از
چگونگی تهیه بعضی از گازها
How to Prepare Gases
Chemistry Lab Instructions
You can use common chemistry lab chemicals and equipment to prepare several gases. A conical flask, thistle funnel, delivery tube, pneumatic trough, and beehive are useful items to have on hand. Please make sure you are familiar with the use and functioning of the laboratory equipment you use, are aware of the characteristics of the substances (toxicity, flammability, explosivity, etc.), and take proper safety precautions. Use a ventilation hood (fume cupboard) and keep flammable gases away from heat or flame. I've tried to be as accurate as possible in my instructions, but you use them at your own risk. For convenience, I've listed the gases in alphabetical order.
ادامه مطلب ...موازنه معادله یک واکنش شیمیایی
چند موازنه معادله واکنش شیمیایی به درخواست دوستان عزیز بازدید کننده:
الف - تشکیل آمونیاک
_ N2 + _ H2 ---> _ NH3
ب - واکنش های سوختن
_ CH4 + _ O2 ---> _ H2O + _ CO2
ج - موازنه معادلات یونی با یون های چند اتمی
_ Ag+(NO3)- + _ Ca2+Cl-2 ---> _ Ag+Cl- + _ Ca2+ (NO3) -2
د - موازنه معادلات یونی که آب محصول آن ها ست
برای اطلاع بیشتر لطفا به آدرس زیر مراجعه فرمایید.
آشنایی با نانو الماس

آشنایی با نانو الماس
الماس از کربن خالص تشکیل شده و سیستم تبلور آن مکعبی ساده (Cubic) است. وزن مخصوص الماس g/cm 5 ضریب شکــست آن 42/2 و سختی آن در مقیاس موس ، مساوی 10 است [14و15]. الماس دارای مصارف صنعتی و زینتی است. گرچه الماس بیشتر به عنوان بخش زینت شناخته می شود، ولی بیش از 80 درصد آن به مصارف صنعتی میرسد. مصارف عمده الماس در صنعت جهت برش مواد بسیار سخت نظیر فولادهای آلیاژی و کاربید تنگستن ، ساییدن ، اره کردن سنگ و بتون و حفاریها و بخش عمده ای هم بعنوان افزودنی به روغن های روان کننده و روان کاوها بکار میرود.
رزینهای مبادله کننده یون
پدیده تبادل یون برای اولین بار در سال 1850 و به دنبال مشاهده توانایی خاکهای زراعی در تعویض برخی از یونها مثل آمونیوم با یون کلسیم و منیزم موجود در ساختمان آنها گزارش شد. در سال 1870 با انجام آزمایشهای متعددی ثابت شد که بعضی از کانیهای طبیعی بخصوص زئولیتها واجد توانایی انجام تبادل یون هستند. در واقع به رزینهای معدنی ، زئولیت میگویند و این مواد یونهای سختی آور آب (کلسیم و منیزیم) را حذف میکردند و به جای آن یون سدیم آزاد میکردند از اینرو به زئولیتهای سدیمی مشهور شدند که استفاده از آن در تصفیه آب مزایای زیاد داشت چون احتیاج به مواد شیمیایی نبود و اثرات جانبی هم نداشتند.
اما زئولیتهای سدیمی دارای محدودیتهایی بودند. این زئولیتها میتوانستند فقط سدیم را جایگزین کلسیم و منیزیم محلول در آب نمایند و آنیونهایی از قبیل سولفات ، کلراید و سیلیکاتها بدون تغییر باقی میمانند. واضح است چنین آبی برای صنایع مطلوب نیست. پس از انجام تحقیقات در اواسط دهه 1930 در هلند زئولیتهایی ساخته شد که به جای سدیم فعال ، هیدروژن فعال داشتند. این زئولیتها که به تعویض کنندههای کاتیونی هیدروژنی معروف جدید ، سیلیس نداشته و علاوه بر این قادرند همزامان هم سختی آب را حذف کنند و هم قلیائیست آب را کاهش دهند.
برای بهبود تکنولوژی تصفیه آب ، گامهای اساسی در سال 1944 برداشته شد که باعث تولید زرینهای تعویض آنیونی شد. زرینهای کاتیونی هیدروژنی تمام کاتیونی آب را حذف میکنند و رزینهای آنیونی تمام آنیونهای آب را از جمله سیلیس را حذف مینمایند ، در نتیجه میتوان با استفاده از هر دو نوع زرین ، آب بدون یون تولید کرد. همچنین پژوهشگران دریافتند که سیلیکات آلومینیم موجود در خاک قادر به تعویض یونی میباشد. این نتیجه گیری با تهیه ژل سیلیکات آلومینیم از ترکیب محلول سولفات آلومینیم و سیلیکات سدیم به اثبات رسید. بنابراین اولین رزین مصنوعی که ساخته شد سیلیکات آلومینیم بود. و امروزه اکثر زرینهای تعویض یونی که در تصفیه آب بکار میروند رزینهای سنتزی هستند که با پلیمریزاسیون ترکیبات آلی حاصل شدهاند.
◄ شیمی رزینها:
ادامه مطلب ...زغال فعال شده (Activate Carbon) چیست ؟

زغال فعال شده (Activate Carbon) چیست ؟ اصطلاح زغال فعال شده نشان دهنده یک سری از مواد جذب کننده سطحی , با جنسی زغالی و شکل کریستالی می باشد که در ساختار داخلی آن روزنه های زیادی وجود دارد.زغال فعال شده دارای کاربردهای زیادی است, از جمله مصارف آن:
- تصفیه آبها ( آب شرب, آب آکواریومها, آبهای صنعتی), از نظر رنگ و بو و طعم
- رنگزدایی از قند و شکر
- بازیافت طلا
- بهسازی رنگ و طعم در نوشیدنی ها و آب میوه ها
- استفاده در دستگاههایی مثل: تصفیه کننده های هوا, خوش بو کننده ها, تصفیه کننده های صنعتی و ...
پلی اورتان ها
از ترکیب یک ماده از گروه استرها و دی ایزوسیانات بدست می اید که در تهیه اسفنجها، الیاف مصنوعی، رنگها، چسبها، روکش ها و الاستومرها بکار برده می شود.
خواص:از بارزترین خصوصیات این گروه مقاومت در برابر سایش و ضربه پذیر بودن می باشـــد.
کاربرد: ساخت قالبهای الاستیکی، الگوبرداری از سطوحی که نیاز به وضوح کامل دارند، مدل ســازی، الگوسازی،راپید پروتوتایپ ، مراحل کم فشار در قالبهای تزریقی، قالبهای مقاوم در برابر کشش، شبیـــه سازی ترموپلاستیکی مانند پلی پروپیلن ها، وکیوم کستینگ های سنگین و بزرگ، مدل های بسیارشـفاف ،الگوبرداری از سطوح صاف ؛ تکثیر قالبهای بتنی و سرامیکی؛ قالب گیری برای مدلهایی که تکــثیر جزئیات درآنها اهمیت دارد ساخت نمونه مستر ؛ ساخت نمونه اصلی برای قالب های وکیوم فرمینــــگ ؛ ساخت قالب با مقاومت های سایشی بالا ساخت قالب های بزرگ و کوچک و ساخت قالبهای سریع تنظیم شده جهت ریخته گری های بزرگ و ضخیم.
◄ پلی اورتان های انعطاف پذیر:
سیستم با ویسکوزیته بسیار پائین آن برای قالبسازی و قسمتهایی از پروتوتایپ که باید الاستومری باشند استفاده می شود. این سیستم در برابر پارگی بسیار مقاوم است و کشسانی آن نیز بسیار بالاست.از آن درریخته گی های سطحی ، قالبهای بتونی و سرامیکی استفاده می شود و محدودیت حجمی ندارد.
◄ پلی اورتان های سخت فیلتردار:
ادامه مطلب ...تقطیر با بخار آب
غالبا به کمک تقطیر با بخار آب میتوان ترکیبات آلی فراری را که با آب مخلوط نمیشوند یا تقریبا با آن غیر قابل اختلاط هستند تفکیک و تخلیص کرد. در این روش مخلوط آب و جسم آلی با هم تقطیر میشوند. که به دو صورت امکان پذیر است:
1) روش مستقیم: که مخلوط آب و ماده آلی با همدیگر حرارت داده میشوند (تقطیر بوسیله آب).
2) روش غیر مستقیم: که بخار آب را در ظرف دیگری ایجاد کرده و از داخل ماده آلی عبور میدهند.
در تقطیر با بخار آب طبق قانون دالتون فشار بخارهای حاصله در درجه حرارت معین، برابر با مجموع فشارهای جزئی همان بخارها است:
PT = P1 + P2 + P3 + …
از این عبارت چنین بر می اید که همواره در هر درجه حرارتی فشار بخار کل مخلوط حتی از فشار بخار فرار ترین جزء در آن درجه حرارت بیشتر است، زیرا که فشار بخار اجزای دیگر مخلوط هم دخالت میکنند. بنابر این باید درجه جوش مخلوط ترکیبهای غیر قابل اختلاط کمتر از جزئی باشد که کمترین نقطه جوش را دارد.
آب (با نقطه جوش 100 درجه) و بروموبنزن (با نقطه جوش 156 درجه) در یکدیگر نامحلولند. این مخلوط در حدود 95 درجه سانتیگراد میجوشد. در این درجه، فشار بخار کل مخلوط برابر با فشار آتمسفر است. همانگونه که طبق نظریه دالتون پیش بینی میشد این درجه کمتر از نقطه جوش هر یک از این دو ماده به صورت خالص است.
ادامه مطلب ...تقارن

مفاهیم تقارن میتوانند به مقدار خیلی زیادی در شیمی ، مفید باشند. از طریق تجزیه و تحلیل خواص تقارنی مولکولها ، میتوان طیف زیر قرمز را پیشبینی کرد، انواع اوربیتالهای مورد استفاده را در پیوند شرح داد و تعدادی از خواص جنبی مولکولها را مطالعه کرد.
عناصر و اعمال تقارن
همه مولکولها را میتوان بر حسب تقارنهای آنها تعریف کرد، حتی............
اگر فقط بگوییم که آنها ، هیچ تقارنی ندارند. مولکولها یا اجسام دیگر ممکن است دارای عناصر تقارن نظیر صفحههای آینهای ، محورهای چرخشی و مراکز وارونگی باشند. انعکاس ، چرخش یا وارونگی واقعی را عمل تقارن مینامند. اکثر این عناصر و اعمال تا اندازه ای آشنا هستند، اما برای کاربردهای عملی در شیمی باید کاملا با آن آشنا شد.
برای اینکه مولکولی ، عنصر تقارن معینی را داشته باشد، شکل ظاهری آن بعد از عمل تقارن که از زاویه یکسانی از مولکول گرفته شده است (اگر چنین عکسهایی امکان پذیر باشند) باید غیرقابل تشخیص باشند. اگر بعد از انجام یک عمل تقارنی ، مولکول حاصل به هر طریقی از مولکول اولیه قابل تشخیص باشد، در آن صورت ، آن عمل ، جزو اعمال متقارن مولکول نیست.
عمل یکسانی (E)
اولین عمل ، عمل یکسانی (E) است که بهمنظور تکمیل مجموعه اعمال ریاضی گنجانده شده است. این عمل ، هیچ تغییری در مولکول ایجاد نمیکند. هر مولکولی ، یک عمل یکسانی دارد، حتی اگر هیچ تقارنی نداشته باشد.
عمل انعکاسی (σ)
عمل بعدی ، عمل انعکاسی (σ) ، موقعی وجود دارد که مولکول ، دارای یک صفحه آینهای باشد. اگر جزئیاتی نظیر آرایش موها و محل اندامهای داخلی را در نظر نگیریم، بدن انسان دارای یک صفحه آینهای چپ - راست میباشد. بسیاری از مولکولها ، صفحه آینهای دارند، اگرچه ممکن است در نگاه اول آشکار نباشد. عمل انعکاس ، جای چپ و راست را عوض میکند، مانند اینکه هر نقطه بهطور عمود از میان صفحه به موقعیتی دقیقا در همان فاصله از صفحه که در آغاز بود، حرکت کرده است.
مولکولها میتوانند به هر تعدادی صفحه آینهای داشته باشند. اجسام خطی نظیر یک مداد چوبی گرد یا مولکولهای همچون استیلن و کربن دیاکسید دارای تعداد نامحدودی صفحه آینهای هستند که همه آنها دربرگیرنده محور مرکزی جسم میباشند.
عمل چرخشی (Cn)
عمل چرخشی که چرخش متعارف نیز نامیده میشود، مستلزم چرخش به اندازه 360بر n درجه حول محور چرخش است. CHCl3 نمونه ای از مولکولهایی است که دارای محور درجه سه (C3) میباشند و در آن ، محور چرخش بر محور پیوند C-H منطبق است. اگر چرخش C3 دوبار پشت سرهم انجام میگیرد، یک چرخش جدید ˚240حاصل میشود که با C23 نشان داده شده و جزو اعمال تنقارن مولکولی نیز میباشد.
سه عمل متوالی C3 برابر عمل یکسانی است (C33=E) که در همه مولکولها وجود دارد. بسیاری از مولکولها و اجسام دیگر محورهای چرخش متعددی دارند.
دانههای برف
دانههای برف ، نمونههایی در این مورد هستند، با شکلهای پیچیده ای که معمولا شش گوشهای تقریبا مسطح است. خطی که عمود بر صفحه دانه برف از مرکز آن گذشته ، دربرگیرنده یک محور درجه دو (C2) ، یک محور درجه سه (C3) و یک محور درجه شش (C6) است. دقت کنید که چرخش به اندازه ˚240 (C23) و ˚300 (C56) نیز جزو اعمال تقارن دانه برف میباشند.
همچنین دو مجموعه سهتایی دیگر از محورهای C2 در صفحه دانه برف وجود دارد که یک مجموعه از نقطههای متقابل و مجموعه دیگر از وسط اضلاع میان نقطهها میگذرد. در مولکولهای دارای بیش از یک محور چرخشی ، محور Cn دارای بزرگترین مقدار n ممکن بهعنوان محور چرخش با بزرگترین مرتبه یا محور اصلی تعیین میشود.
محور چرخش با بزرگترین مرتبه در دانه برف ، محور C6 است. (در موقع انتقال به مشخصات کارتزین ، محور Cn با بزرگترین مرتبه معمولا بهعنوان محور Z انتخاب میشود). در صورت لزوم ، محورها C2 عمود بر محور اصلی را با پریم مشخص میکنند. یک تک پریم نشان میدهد که محور از داخل چندین اتم مولکول میگذرد، در حالیکه یک جفت پریم نشان میدهد که محور از بین اتمها میگذرد.
عمل وارونگی (i)
این عمل ، کمی پیچیدهتر است. هر نقطه از وسط مرکز مولکول به موقعیتی مقابل موقعیت اولیه حرکت میکند، بهطوریکه فاصله اش از نقطه مرکزی برابر با فاصله ای باشد که در آغاز داشت. اتان در حالت صورتبندی نامتقابل نمونه ای از مولکولهایی است که دارای مرکز وارونگی میباشند. بسیاری از مولکولها که در نگاه اول به نظر میرسد مرکز وارونگی دارند، فاقد آن هستند. متان و مولکولهای چهار وجهی دیگر ، نمونههایی از این مولکولها هستند.
اگر دو اتم هیدروژن یک مدل متان در صفحه عمودی سمت راست و دو اتم هیدروژن دیگرش در صفحه افقی در چپ نگاه داشته شود، عمل وارونگی دو هیدروژن واقع در صفحه افقی را به سمت راست و دو هیدروژن واقع در صفحه عمودی را به سمت چپ منتقل میکند. پس متان ، عمل وارونگی ندارد، چون جهتگیری مولکول پس از عمل i با جهتگیری اولیه متفاوت است.
بطور کلی ، چهار وجهیها ، مسطح مثلثیها ، پنج ضلعیها مرکز وارونگی ندارند. مربعها ، متوازیالاضلاعها ، اجسام راستگوشه و دانههای برف مرکز وارونگی دارند.
عمل چرخش- انعکاس (Sn)
این عمل که گاهی اوقات ، چرخش نامتقارن نامیده میشود، مستلزم چرخش به اندازه 360 بر n درجه و به دنبال آن ، انعکاس از صفحه عمود بر محور چرخش میباشد. برای مثال ، در متان ، خطی که از وسط کربن عبور کرده و زاویه میان هیدروژنها را در طرفین نصف میکند، یک محور S4 میباشد. از این نوع خط سه تا و در کل سه محور S4 وجود دارد. این عمل ، مستلزم چرخش مولکول به اندازه ˚90 و سپس انعکاس از صفحه آینهای عمود میباشد. دو عمل متوالی Sn یک محور Cn/2 ایجاد میکند. در متان ، دو عمل S4 یک C2 ایجاد میکند.
بعضی وقتها ممکن است محور Sn مولکول با محور Cn آن منطبق باشد. مثلا دانههای برف ، علاوه بر محورهای چرخش اشاره شده در بالا ، محورهای S2 ، S3 و S6 منطبق بر محور C6 نیز دارند. دقت کنید که محور S2 با وارونگی و محور S1 با صفحه آینهای یکسانی هستند. در مورد اول ، نماد i و در مورد دوم نماد σ ترجیح داده میشود.
چگونگی جوشیدن یک مایع

نقطه جوش یک مایع به صورت درجه حرارتی تعریف میشود که در آن فشار بخار مایع برابر با فشار بیرونی باشد. چنانچه فشار خارج 760 میلیمتر جیوه باشد. یک مایع وقتی خواهد جوشید که فشار بخار آن برابر با این مقدار باشد. برای مثال آب وقتی از دمای 100Cْ خواهد جوشید که فشار خارجی و فشار بخار آن برابر با 760 مییلیمتر جیوه باشد. در فشار 526 میلیمتر جیوه آب در 90Cْ میجوشد و اگر فشار را به 9.2 میلیمتر برسانیم نقطه جوش آب در 10Cْ خواهد بود به این علت است که نقطه جوش آب در ارتفاعات کمتر از مناطق نزدیک به سطح دریا میباشد.
فشار بخار
مولکولهای یک مایع دارای انرژی جنبشی هستند و انرژی جنبشی مولکول معینی از یک مایع ضمن برخورد با سایر مولکولها دائما تغییر میکند. در یک لحظه معین تعدادی از مولکولها دارای انرژی نسبتا زیاد و تعدادی دارای انرژی نسبتا کمی هستند مولکولهایی که انرژی جنبشی آنها زیاد است میتوانند بر نیروی جاذبه مولکولهای اطراف خود غلبه کرده و از سطح مایع فرار کرده و وارد فاز گاز میشوند.
اگر مایع در حال تبخیر در یک ظرف سربستهای محبوس باشد مولکولهای بخار نمیتوانند از نزدیکی مایع دور شوند و تعدادی از مولکولهای بخار به فاز مایع بر میگردند سرانجام حالتی پیش میآید که در آن سرعت فرار مولکولها از فاز مایع به بخار (تبخیر) و سرعت برگشت مولکول از فاز بخار به مایع (میعان) برابر میشود. فشار بخاری که در دمای معین با مایع خود در حال تعادل است، فشار بخار نامیده میشود.
کوانتوم به زبان ساده
نیلز بور(1962 - 1885) ، از بنیانگذاران فیزیک کوانتوم، در مورد چیزی که بنیان گذارده است، جملهای دارد به این مضمون که اگر کسی بگوید فیزیک کوانتوم را فهمیده ، پس چیزی نفهمیده است.
تقسیم ماده
از یک رشتهی دراز ماکارونی پخته شروع میکنیم. اگر این رشتهی ماکارونی را نصف کنیم، بعد نصف آن را هم نصف کنیم، بعد نصف نصف آن را هم نصف کنیم و ... شاید آخر سر به چیزی برسیم، البته اگر چیزی بماند! که به آن مولکولل ماکارونی میتوان گفت؛ یعنی کوچکترین جزئی که هنوز ماکارونی است. حال اگر تقسیم کردن را باز هم ادامه بدهیم، حاصل کار خواص ماکارونی را نخواهد داشت، بلکه ممکن است در اثر ادامه تقسیم ، به مولکولهای کربن یا هیدروژن یا ... بر بخوریم.
این وسط ، چیزی که به درد ما میخورد (یعنی به درد نفهمیدن کوانتوم!) این است که دست آخر ، به اجزای گسستهای به نام مولکول یا اتم میرسیم. این پرسش از ساختار ماده که آجرک ساختمانی ماده چیست؟ ، پرسشی قدیمی و البته بنیادی است. ما به آن ، به کمک فیزیک کلاسیک، چنین پاسخ گفتهایم: ساختار ماده ، ذره ای و گسسته است؛ این یعنی نظریه مولکولی.
تقسیم انرژی
ادامه مطلب ...ویژگیها و روش های آزمون رنگ پلی اورتان دو جزئی
ایزو سیانات، هسته مرکزی پلی اورتان
در شیمی غیر آلی اسید سیانیک و به ویژه املاح فلزی آن تحت نام سیانات ها شناخته شده و در دسترس می باشد، در حالیکه ترکیب به نام ایزوسیانیک اسید حتی برای زمان بسیار کوتاه نیز فاقد موجودیت است. در صورتیکه در شیمی آلی در صورت عدم وجود رطوبت در محیط، ترکیباتی که دارای یک یا چند گروه فعال ایزوسیانات باشند به فراوانی قابل تهیه، نگهداری و استفاده می باشد:
فرمول R می تواند آلیفاتیک، آروماتیک، هیدروآرماتیک (سیکلو آلیفاتیک) باشد.
خلاصه ای درباره شیمی ایزوسیانات
گروه NCO_ (عامل ایزوسیانات) واکنش گرائی بسیار بالائی دارد. عمده .....


